Hvordan fungerer svovldioxid som et dehydreringsmiddel?
$ So_2 (g) + h_2o (l) \ Rightleftharpoons H_2SO_3 (aq) $
Denne reaktion er reversibel og resulterer ikke nødvendigvis i fjernelse af vand fra et stof.
Her er hvorfor $ so_2 $ ikke betragtes som et typisk dehydreringsmiddel:
* reversibilitet: Reaktionen med vand vendes let, hvilket betyder, at svovlsyren kan nedbrydes tilbage til $ SO_2 $ og vand.
* svag syre: Svovlsyre er en svag syre, hvilket gør den mindre effektiv til at fjerne vand sammenlignet med stærke syrer som svovlsyre.
* begrænset reaktivitet: $ SO_2 $ reagerer primært med vand for at danne svovlsyre, men det reagerer ikke let med andre forbindelser for at fjerne vand.
Selvom $ SO_2 $ kan reagere med vand, er det ikke et primært dehydreringsmiddel. Dens rolle i kemiske reaktioner er mere fokuseret på dens sure egenskaber og dens evne til at fungere som et reduktionsmiddel i nogle tilfælde.
Sidste artikelFormel for forbindelsen, der dannes mellem calcium og nitrogen?
Næste artikelHar kulstof større atomer end fluor?
 Varme artikler
Varme artikler
-
 Polymerfilm beskytter mod elektromagnetisk stråling, signalinterferensEn polymerfilm fyldt med kvasi-1D TaSe 3 nanotråde. Kredit:Zahra Barani/UC Riverside Da elektroniske enheder mætter alle hjørner af det offentlige og personlige liv, ingeniører kæmper for at fin
Polymerfilm beskytter mod elektromagnetisk stråling, signalinterferensEn polymerfilm fyldt med kvasi-1D TaSe 3 nanotråde. Kredit:Zahra Barani/UC Riverside Da elektroniske enheder mætter alle hjørner af det offentlige og personlige liv, ingeniører kæmper for at fin -
 Guldbindingsdannelse spores i realtid ved hjælp af ny molekylær spektroskopi-teknikFigur 1:Et formskiftende molekyle snapper fra en bøjet (øverst til højre) til en lige struktur (nederst til højre), når det rammes af en ultraviolet laserimpuls (lilla krumspring øverst i midten). To
Guldbindingsdannelse spores i realtid ved hjælp af ny molekylær spektroskopi-teknikFigur 1:Et formskiftende molekyle snapper fra en bøjet (øverst til højre) til en lige struktur (nederst til højre), når det rammes af en ultraviolet laserimpuls (lilla krumspring øverst i midten). To -
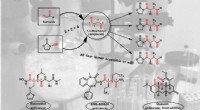 Når svovl forsvinder sporløstNy selektiv syntese af alle 1, 4-dicarbonylisomerer fra sulfoxider og udvalgte vigtige bioaktive forbindelser med 1, 4-dicarbonylmotiv. Kredit:© Maulide Group Mange naturprodukter og lægemidler ha
Når svovl forsvinder sporløstNy selektiv syntese af alle 1, 4-dicarbonylisomerer fra sulfoxider og udvalgte vigtige bioaktive forbindelser med 1, 4-dicarbonylmotiv. Kredit:© Maulide Group Mange naturprodukter og lægemidler ha -
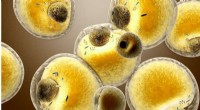 Østrigske forskere letter lipiddataanalyseLipid Data Analyzer vil lette arbejdet enormt inden for biomedicinsk forskning og absolut fremskynde lipidforskningen. På billedet:adipocytter, cellerne i fedtvæv. Kredit:spectralDesign - fotolia.com
Østrigske forskere letter lipiddataanalyseLipid Data Analyzer vil lette arbejdet enormt inden for biomedicinsk forskning og absolut fremskynde lipidforskningen. På billedet:adipocytter, cellerne i fedtvæv. Kredit:spectralDesign - fotolia.com
- Bekæmpelse af lægemiddelresistens med hurtig, kunstig forstærkning af naturlige produkter
- Hvornår sker replikation under mitose eller meiose?
- Astronomer kortlægger massiv struktur ud over Laniakea Supercluster
- På trods af føderalt moratorium, Amerikanske fraflytningsrater vender tilbage til præ-pandeminive…
- Er et stykke træ en isolator eller leder?
- I hvilken situation er gravitationskraften mellem to objekter, der er svært at opdage?


