Hvad er reaktionen af jernmetal med ilt til dannelse af jern LLL -oxid?
4 Fe (S) + 3 O₂ (G) → 2 Fe₂o₃ (S)
Forklaring:
* Fe (s) Repræsenterer jernmetal i sin faste tilstand.
* o₂ (g) Repræsenterer iltgas.
* fe₂o₃ (s) Repræsenterer jern (III) oxid, også kendt som rust, i sin faste tilstand.
Hvad sker der i reaktionen:
1. jernatomer På overfladen af metal reagerer med iltmolekyler i luften.
2. Denne reaktion kræver aktiveringsenergi , som kan leveres af varme eller en gnist.
3.. Jernatomerne mister elektroner og danner jern (III) -ioner (Fe³⁺) .
4. iltmolekylerne får elektroner og danner oxidioner (O²⁻) .
5. Disse ioner kombineres til dannelse af jern (III) oxid (Fe₂o₃) , en fast forbindelse, der danner det rødbrune lag af rust.
Bemærk:
* Denne reaktion er eksoterm , hvilket betyder, at det frigiver varme.
* Rustformationsprocessen er relativt langsom ved stuetemperatur, men accelererer i nærvær af fugt og visse salte.
 Varme artikler
Varme artikler
-
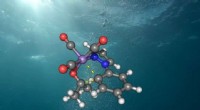 Det nye grønne alternativ til medicinproduktionStruktur af den aktive mangankatalysator i vand. Kredit:Universitetet i Göttingen De fleste af processerne til fremstilling af lægemidler, pesticider og smartphone-skærme er omkostningstunge og ge
Det nye grønne alternativ til medicinproduktionStruktur af den aktive mangankatalysator i vand. Kredit:Universitetet i Göttingen De fleste af processerne til fremstilling af lægemidler, pesticider og smartphone-skærme er omkostningstunge og ge -
 Halvledergennembrud kan være en game-changer for organiske solcellerEn organisk solcelletest inde i Randall Lab på Central Campus Ann Arbor, MI. Forskere fra University of Michigan har fundet en måde at lokke elektroner til at rejse meget længere, end man tidligere tr
Halvledergennembrud kan være en game-changer for organiske solcellerEn organisk solcelletest inde i Randall Lab på Central Campus Ann Arbor, MI. Forskere fra University of Michigan har fundet en måde at lokke elektroner til at rejse meget længere, end man tidligere tr -
 Transparente belægninger til hverdagsbrugFluoroporbelægning på en tynd kobberfilm. Kredit:Bastian E. Rapp, SÆT Vand- og smudsafvisende sportstøj og udendørstøj, eller anti-dug forruder – der er mange hverdagsprodukter, der kan drage ford
Transparente belægninger til hverdagsbrugFluoroporbelægning på en tynd kobberfilm. Kredit:Bastian E. Rapp, SÆT Vand- og smudsafvisende sportstøj og udendørstøj, eller anti-dug forruder – der er mange hverdagsprodukter, der kan drage ford -
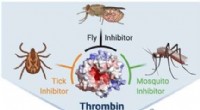 Potente trivalente hæmmere af thrombin fra antikoaguleringspeptider i insektspytKredit:Angewandte Chemie International Edition Trombose, tilstopning af blodkar, er en væsentlig årsag til hjerteanfald og emboli. Forskere har nu konstrueret de første hæmmere af thrombin, en pro
Potente trivalente hæmmere af thrombin fra antikoaguleringspeptider i insektspytKredit:Angewandte Chemie International Edition Trombose, tilstopning af blodkar, er en væsentlig årsag til hjerteanfald og emboli. Forskere har nu konstrueret de første hæmmere af thrombin, en pro
- NASAs nye lette røntgenspejle klar til afprøvning i rummet
- Hudbiologi belyser, hvordan stamceller fungerer
- Hvorfor krystalliseres kobbersulfatopløsning?
- Er der et mønster af antallet af dages mellem sol- og måneformørkelser?
- Hvordan aftager tiltrækningskraften?
- Millioner af gnister:Vejret øger australiernes brandfare


