Hvorfor er Ag Cl opløselig i natriumthiosulfat?
* AGCL er et sparsomt opløseligt salt. Det har et meget lavt opløselighedsproduktkonstant (KSP), hvilket betyder, at den ikke opløses let i vand.
* thiosulfationer (S2O3^2-) er gode ligander. De kan danne koordinatbindinger med sølvioner (Ag+).
* kompleks iondannelse: Når AGCL tilsættes til en natriumthiosulfatopløsning, opstår følgende reaktion:
AGCL (S) + 2S2O3^2- (aq) ⇌ [AG (S2O3) 2]^3- (aq) + Cl- (aq)
Denne reaktion resulterer i dannelsen af en stabil kompleks ion, [AG (S2O3) 2]^3- , kaldet dicyanoargentate (i) ion . Denne komplekse ion er opløselig i vand, hvilket effektivt fjerner sølvioner fra opløsning og driver ligevægten til højre, hvilket får flere AgCl til at opløses.
Kortfattet:
Opløseligheden af AgCl i natriumthiosulfat skyldes ikke direkte opløsning af AgCl i thiosulfatopløsningen. I stedet er det drevet af dannelsen af en opløselig kompleks ion, [Ag (S2O3) 2]^3-, som fjerner sølvioner fra opløsning, hvilket gør det muligt for flere AgCl at opløses. Denne proces er kendt som kompleksation .
Sidste artikelHar en pimpsten rock reaktion med eddike?
Næste artikelHvilken form er et carbonchlormolekyle?
 Varme artikler
Varme artikler
-
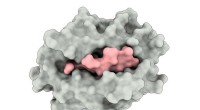 En gang nedsat bindingsmekanisme kan være nøglen til at målrette virusEn illustration viser et større histokompatibilitets (gråt) protein, der omfatter et peptid hentet fra et SARS-CoV-virus (pink). Komplekset hjælper med at udløse aktiveringen af T -celler, der er en
En gang nedsat bindingsmekanisme kan være nøglen til at målrette virusEn illustration viser et større histokompatibilitets (gråt) protein, der omfatter et peptid hentet fra et SARS-CoV-virus (pink). Komplekset hjælper med at udløse aktiveringen af T -celler, der er en -
 Metaller påvirker C-peptidhormon relateret til insulinUC Davis kemiker Marie Heffern er banebrydende på et nyt felt, metalloendokrinologi, at udforske, hvordan metaller som jern, zink og kobber påvirker hormoner. Kredit:Gregory Urquiaga/UC Davis Meta
Metaller påvirker C-peptidhormon relateret til insulinUC Davis kemiker Marie Heffern er banebrydende på et nyt felt, metalloendokrinologi, at udforske, hvordan metaller som jern, zink og kobber påvirker hormoner. Kredit:Gregory Urquiaga/UC Davis Meta -
 Fra laboratorium til plade:Gummibeton bøjer sig ind på boligmarkedetCirka 1,5 milliarder bildæk kasseres hvert år. Kredit:Pixabay/Berger-Team En ny tilgang til gummigenanvendelse kunne se udtjente dæk omdannet til beton til boligbyggerier, da ny forskning fra Unive
Fra laboratorium til plade:Gummibeton bøjer sig ind på boligmarkedetCirka 1,5 milliarder bildæk kasseres hvert år. Kredit:Pixabay/Berger-Team En ny tilgang til gummigenanvendelse kunne se udtjente dæk omdannet til beton til boligbyggerier, da ny forskning fra Unive -
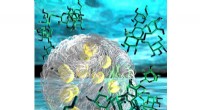 Syntetisk organel viser, hvordan bittesmå vandpytter-organer i vores celler fungererEn illustration af en del af en syntetisk organel uden membran. Her ser vi to lag, der fase adskilles som olie og vand, men begge lag er vand. Der er ingen olie. Hvert lag indeholder et andet opløst s
Syntetisk organel viser, hvordan bittesmå vandpytter-organer i vores celler fungererEn illustration af en del af en syntetisk organel uden membran. Her ser vi to lag, der fase adskilles som olie og vand, men begge lag er vand. Der er ingen olie. Hvert lag indeholder et andet opløst s
- Hvordan påvirker soda -syreindholdet alumium?
- Når du gnider dine fødder på et tæppe mister du elektroner. Hvad skete der?
- Hvor har en satellit i elliptisk bane sin største samlede energi?
- Hvilken geologisk teori kan opsummeres med sætningen til stede er nøglen til
- Global database med data for næsten 3.000 orkidéarter viser diversitetsbestøvningsstrategier
- Hvor mange måner kan passe over solen?


