Hvorfor boron danner elektronmangelforbindelse?
1. Elektronisk konfiguration:
* Bor har tre valenselektroner (2S² 2P¹).
* For at opnå en stabil octet har den brug for yderligere fem elektroner.
2. Binding:
* Boren foretrækker at danne kovalente bindinger og dele elektroner med andre atomer.
* Det kan dog kun danne tre kovalente bindinger på grund af dets begrænsede valenselektroner.
* Dette efterlader det med kun seks elektroner i sin valensskal, to elektroner, der er mindre end en oktet.
3. Elektronmangel:
* Den resulterende forbindelse kaldes en elektronmangel forbindelse .
* Disse forbindelser mangler det fulde komplement af elektroner, der kræves til en stabil oktet.
4. Rollen af tomme orbitaler:
* Bor kan bruge sin tomme 2p orbital til at acceptere elektroner fra de nærliggende atomer.
* Dette hjælper med at kompensere for elektronmangel, men ikke helt.
* Dette resulterer i stærke bindinger med høj kovalent karakter, men skaber også en høj elektronbehov i forbindelsen.
Eksempler:
* Borane (bh₃): Det har kun seks valenselektroner omkring boratomet, hvilket gør det elektronmangel. Den accepterer let elektroner fra andre molekyler og danner addukter.
* diborane (b₂h₆): Det er et klassisk eksempel på en elektronmangelforbindelse. Det har tre-center to-elektronbindinger (3C-2E), hvor to boratomer deler et par elektroner med et brodannende hydrogenatom. Dette muliggør dannelse af stabile bindinger på trods af elektronmangel.
Konsekvenser af elektronmangel:
* Høj reaktivitet: Elektronmangelforbindelser er meget reaktive på grund af deres stærke elektronbehov.
* lewis surhed: De accepterer let elektronpar og fungerer som Lewis -syrer.
* usædvanlige strukturer: De vedtager ofte usædvanlige strukturer for at minimere elektronmangel, som de brodannende hydrogenatomer i diboran.
Kortfattet: Borons begrænsede valenselektroner og behovet for at opnå en stabil oktet fører til dannelse af elektronmangelforbindelser. Disse forbindelser er kendetegnet ved deres stærke elektronbehov, høj reaktivitet og Lewis -surhedsgrad.
Sidste artikelHvad er den sammensatte CU20?
Næste artikelHvad er molariteten af chloridion i 100 ml en 500 m bariumopløsning?
 Varme artikler
Varme artikler
-
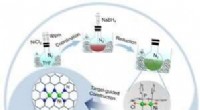 Forskere designer dinuclear-site katalysatorer og afslører den underliggende mekanismeSynteseskema. Kredit:DING Tao et al. Dinuclear-site katalysatorer (DSCer) har tiltrukket sig mere og mere opmærksomhed fra forskere på grund af deres fremragende katalytiske evne ved at inkorporer
Forskere designer dinuclear-site katalysatorer og afslører den underliggende mekanismeSynteseskema. Kredit:DING Tao et al. Dinuclear-site katalysatorer (DSCer) har tiltrukket sig mere og mere opmærksomhed fra forskere på grund af deres fremragende katalytiske evne ved at inkorporer -
 Biomateriale kunne holde tænderne i live efter rodbehandlingKredit:CC0 Public Domain En rodbehandling står højt på de flestes liste over frygtede tandbehandlinger. Selvom den lange og til tider smertefulde operation lindrer smerten ved en infektion, en rod
Biomateriale kunne holde tænderne i live efter rodbehandlingKredit:CC0 Public Domain En rodbehandling står højt på de flestes liste over frygtede tandbehandlinger. Selvom den lange og til tider smertefulde operation lindrer smerten ved en infektion, en rod -
 Forskere udvikler nye gennemsigtige bredbånds elektromagnetiske interferensafskærmningsmaterialerFig. Prøverne af gennemsigtige EMI -afskærmningsmaterialer fremstillet gennem (a) et laboratoriefacilitet og (b) et pilotanlæg. Kredit:NIMTE Den fleksible optoelektroniske materialegruppe ledet af
Forskere udvikler nye gennemsigtige bredbånds elektromagnetiske interferensafskærmningsmaterialerFig. Prøverne af gennemsigtige EMI -afskærmningsmaterialer fremstillet gennem (a) et laboratoriefacilitet og (b) et pilotanlæg. Kredit:NIMTE Den fleksible optoelektroniske materialegruppe ledet af -
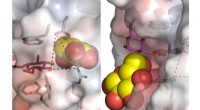 Afdækning af ultrahurtig planteenzymdynamik kan fremme kornproduktion, medicinsk og farmaceutisk in…Strukturelle ændringer af et bygenzym, som forudset ved højopløsnings røntgenkrystallografi og multiskala molekylær modellering. Kredit:University of Adelaide Forskere fra University of Adelaide ha
Afdækning af ultrahurtig planteenzymdynamik kan fremme kornproduktion, medicinsk og farmaceutisk in…Strukturelle ændringer af et bygenzym, som forudset ved højopløsnings røntgenkrystallografi og multiskala molekylær modellering. Kredit:University of Adelaide Forskere fra University of Adelaide ha
- Billede:Lagunetågen (synligt lys)
- Hvilken rolle spiller uafhængig og afhængig variabel i kontrollerede eksperimenter?
- Hvad var fordelene ved at udvikle atommasseenhed for måling af måling?
- Polen, Litauen undersøger russisk-fremstillet app bag virale selfies i alderdommen
- Hvad beskriver bevægelsen af et objekt i hvile, hvis der ikke er nogen ydre kræfter, der handler…
- Isskaltykkelsen afslører vandtemperaturen på havverdener


