Hvad er molariteten af chloridion i 100 ml en 500 m bariumopløsning?
forståelse af konceptet
* Molaritet: Molaritet (M) er en koncentrationsenhed, der repræsenterer antallet af mol opløst stof pr. Liter opløsning.
* bariumchlorid (bacl₂): Bariumchlorid er en ionisk forbindelse, der adskiller sig i vand til dannelse af bariumioner (Ba²⁺) og chloridioner (CL⁻) i et forhold på 1:2.
trin
1. Dissociation ligning:
Bacl₂ (aq) → Ba²⁺ (aq) + 2cl⁻ (aq)
2. mol af bariumchlorid:
* Vi har 100 ml af en 500 m bariumchloridopløsning.
* Konverter ml til liter:100 ml * (1 l / 1000 ml) =0,1 l
* Mol bacl₂ =molaritet * volumen (i liter) =500 m * 0,1 l =50 mol
3. mol chloridioner:
* Fra dissocieringsligningen producerer 1 mol bacl₂ 2 mol cl⁻.
* Mol Cl⁻ =50 mol bacl₂ * (2 mol cl⁻ / 1 mol bacl₂) =100 mol cl⁻
4. Molaritet af chloridioner:
* Molaritet af Cl⁻ =mol Cl⁻ / volumen af opløsning (i liter) =100 mol / 0,1 L = 1000 m
Derfor er molariteten af chloridion i 100 ml af en 500 m bariumchloridopløsning 1000 m.
 Varme artikler
Varme artikler
-
 Nanostrukturering øger effektiviteten af metalfrie fotokatalysatorer med faktor 11PCN -nanolag under sollys kan splitte vand. Kredit:Nannan Meng /Tianjin University En af de store udfordringer ved overgangen til vedvarende energi er at levere energi, selv i mangel af sollys. Br
Nanostrukturering øger effektiviteten af metalfrie fotokatalysatorer med faktor 11PCN -nanolag under sollys kan splitte vand. Kredit:Nannan Meng /Tianjin University En af de store udfordringer ved overgangen til vedvarende energi er at levere energi, selv i mangel af sollys. Br -
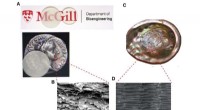 Ubrydeligt glas inspireret af muslingeskaller(A) Glaskomposit (uden indeksmatchingsstrategi til venstre og med indeksmatchning til højre), (B) Glaskomposits mikrostruktur, (C) Udsigt over det nacreøse lag i rød abalone shell, og (D) Nacres mikro
Ubrydeligt glas inspireret af muslingeskaller(A) Glaskomposit (uden indeksmatchingsstrategi til venstre og med indeksmatchning til højre), (B) Glaskomposits mikrostruktur, (C) Udsigt over det nacreøse lag i rød abalone shell, og (D) Nacres mikro -
 Kemikere rapporterer biofornyelig, biologisk nedbrydeligt plastalternativKredit:CC0 Public Domain Colorado State University polymerkemikere har taget endnu et skridt mod en fremtid med høj ydeevne, biofornybar, biologisk nedbrydelig plast. Udgiver i Naturkommunikatio
Kemikere rapporterer biofornyelig, biologisk nedbrydeligt plastalternativKredit:CC0 Public Domain Colorado State University polymerkemikere har taget endnu et skridt mod en fremtid med høj ydeevne, biofornybar, biologisk nedbrydelig plast. Udgiver i Naturkommunikatio -
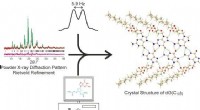 Ny eksperimentel strategi belyser kompleks krystalstrukturForskere ved universiteterne i Warwick og Cardiff har brugt en kombineret pulver XRD, solid-state NMR og beregningsmetode til at bestemme strukturen af 3, 5-bis-O-decanoyl-2-deoxyguanosin. En kombi
Ny eksperimentel strategi belyser kompleks krystalstrukturForskere ved universiteterne i Warwick og Cardiff har brugt en kombineret pulver XRD, solid-state NMR og beregningsmetode til at bestemme strukturen af 3, 5-bis-O-decanoyl-2-deoxyguanosin. En kombi
- Nærmeste eksoplanet endnu bekræftet af European Southern Observatory
- Hvordan måler man en vægt fra fodens størrelse
- Formelle skovforvaltningspolitikker i samfundet fører ofte til reduceret adgang, ressource rettighe…
- Hvor lang jord kræver det at gennemføre en cirkel omkring solen?
- Hvad er entropi fysisk videnskab?
- Typer af kernekraftværker


