Hvis 1,20 gram natriummetal reageres med 3,00 ml vand, hvor mange NaOH vil der blive produceret?
1. Skriv den afbalancerede kemiske ligning:
2 NA (S) + 2 H₂O (L) → 2 NaOH (AQ) + H₂ (G)
2. Beregn molen af natrium (NA):
* Molmasse Na =22,99 g/mol
* Mol Na =(1,20 g) / (22,99 g / mol) =0,0522 mol
3. Bestem den begrænsende reaktant:
* Vand:
* Densitet af vand =1 g/ml
* Masse vand =(3,00 ml) * (1 g/ml) =3,00 g
* Molmasse vand =18,015 g/mol
* Mol vand =(3,00 g) / (18,015 g / mol) =0,166 mol
* forhold: Den afbalancerede ligning viser et forhold på 2:2 mellem Na og H₂O. Dette betyder, at 0,0522 mol NA ville kræve 0,0522 mol H₂O for at reagere fuldstændigt. Da vi har mere vand (0,166 mol) end nødvendigt, er natrium den begrænsende reaktant.
4. Beregn molen af NaOH produceret:
* Den afbalancerede ligning viser et forhold på 2:2 mellem Na og NaOH.
* Mol naOH produceret =0,0522 mol Na * (2 mol NaOH / 2 mol Na) =0,0522 mol NaOH
5. Beregn massen af NaOH produceret:
* Molmasse NaOH =39,997 g/mol
* Massen af NaOH produceret =(0,0522 mol) * (39,997 g/mol) = 2,09 g NaOH
Derfor produceres ca. 2,09 gram NaOH.
Vigtig note: Denne reaktion er meget eksoterm og producerer brintgas, som er brandfarlig. Det skal kun udføres under kontrollerede forhold af en uddannet professionel.
Sidste artikelHvad er ammoniacal cupous chlorid?
Næste artikelEn løsning er en blanding af?
 Varme artikler
Varme artikler
-
 Elektricitetsdrevne undersøiske reaktioner kan have været vigtige for livets opståenForskningsgruppen har foreslået en effektiv mekanisme til at udnytte den kemiske energi, der genereres af varme hydrotermiske væsker, der strømmer ud af hydrotermiske ventilationsåbninger på Jordens t
Elektricitetsdrevne undersøiske reaktioner kan have været vigtige for livets opståenForskningsgruppen har foreslået en effektiv mekanisme til at udnytte den kemiske energi, der genereres af varme hydrotermiske væsker, der strømmer ud af hydrotermiske ventilationsåbninger på Jordens t -
 Høst rent brintbrændstof gennem kunstig fotosynteseDet farvede elektronmikroskopbillede viser galliumnitridtårnene i den kunstige fotosynteseanordning ved 52,5k forstørrelse. Disse nanostrukturer river vandmolekyler fra hinanden til brint og ilt for a
Høst rent brintbrændstof gennem kunstig fotosynteseDet farvede elektronmikroskopbillede viser galliumnitridtårnene i den kunstige fotosynteseanordning ved 52,5k forstørrelse. Disse nanostrukturer river vandmolekyler fra hinanden til brint og ilt for a -
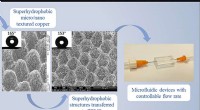 Ny fremstillingsproces skaber supersmå kanaler til at afvise vand og forbedre medicinsk, elektronis…Dette billede viser skabelsen af en superhydrofob overflade på en metaloverflade med en ultrahurtig laser, som overføres til PMDS via transferstøbning og samles til en mikrofluidisk enhed. Kredit:Pu
Ny fremstillingsproces skaber supersmå kanaler til at afvise vand og forbedre medicinsk, elektronis…Dette billede viser skabelsen af en superhydrofob overflade på en metaloverflade med en ultrahurtig laser, som overføres til PMDS via transferstøbning og samles til en mikrofluidisk enhed. Kredit:Pu -
 Ny funktion for planteenzym kan føre til grøn kemiBrookhaven Lab biokemiker John Shanklin med pensioneret biologi associeret Ed Whittle viser et strukturelt billede af et desaturase enzym, der introducerer tilstødende hydroxylgrupper i en fedtsyre. D
Ny funktion for planteenzym kan føre til grøn kemiBrookhaven Lab biokemiker John Shanklin med pensioneret biologi associeret Ed Whittle viser et strukturelt billede af et desaturase enzym, der introducerer tilstødende hydroxylgrupper i en fedtsyre. D
- Californien giver afkald på miljøregler for forberedelse af brandsæsonen
- Hunde genetiske undersøgelser afslører, hvorfor Shar-Peis er rynket
- Hvad betyder materiale skade?
- Alger:Damskum eller Fremtidens mad?
- Er det sandt, at jordoverfladen er dækket af et kontinuerligt lag af soild rock?
- Undersøgelse afslører, hvorfor offentlige appeller kan falde pladask hos nogle potentielle donorer


