En forbindelse, der er sammensat af kulstofhydrogen og ilt, indeholder 70,6 C 5,9 H 23,5 O med masse. Molekylvægten 136 amu. Hvilken formel?
1. Bestem den empiriske formel
* Konverter procenter til gram: Antag, at du har 100 g af forbindelsen. Dette betyder, at du har 70,6 g C, 5,9 g H og 23,5 G O.
* Konverter gram til mol: Del hver masse med det respektive elements molære masse:
* C:70,6 g / 12,01 g / mol =5,88 mol
* H:5,9 g / 1,01 g / mol =5,84 mol
* O:23,5 g / 16,00 g / mol =1,47 mol
* Find det enkleste forhold mellem hele nummer: Del hver molværdi med den mindste molværdi (1,47 mol):
* C:5,88 mol / 1,47 mol =4
* H:5,84 mol / 1,47 mol =4
* O:1,47 mol / 1,47 mol =1
* Den empiriske formel er c₄h₄o
2. Bestem den molekylære formel
* Beregn den empiriske formelmasse: (4 x 12,01 g/mol) + (4 x 1,01 g/mol) + (1 x 16,00 g/mol) =68,06 g/mol
* Find forholdet mellem molekylvægten og den empiriske formelmasse: 136 amu / 68,06 g / mol =2
* Multiplicer underskrifterne i den empiriske formel med dette forhold: C₄h₄o x 2 = c₈h₈o₂
Derfor er den molekylære formel for forbindelsen c₈h₈o₂.
Sidste artikelHvad produceres, når et ikke -metallisk oxid blandet med vand?
Næste artikelKan en ether indeholde en carbonylgruppe?
 Varme artikler
Varme artikler
-
 Forskere præsenterer ny strategi for at udvide duktiliteten i en enfaset legeringA. Multilevel heterogen struktur af enfaset CrCoNi medium entropi-legering efter træktest:korn på størrelse med mikrometer (hvide), submikronkorn (blå), nanokorn (farvede). Nanograin dannes ved korngr
Forskere præsenterer ny strategi for at udvide duktiliteten i en enfaset legeringA. Multilevel heterogen struktur af enfaset CrCoNi medium entropi-legering efter træktest:korn på størrelse med mikrometer (hvide), submikronkorn (blå), nanokorn (farvede). Nanograin dannes ved korngr -
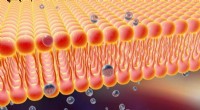 Fluorescerende prober beviser eksistensen af lipidflåde -cellemembranstrukturerKredit:Kyoto Universitet Forskere fra Japan, Indien og USA har for første gang observeret lipid-flåder i levende celler. Disse flåder er aktive sektioner af cellemembranen, der er ansvarlige for s
Fluorescerende prober beviser eksistensen af lipidflåde -cellemembranstrukturerKredit:Kyoto Universitet Forskere fra Japan, Indien og USA har for første gang observeret lipid-flåder i levende celler. Disse flåder er aktive sektioner af cellemembranen, der er ansvarlige for s -
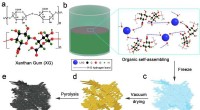 Forskere foreslår nye højtydende dual-ion-batterier med 3-D porøs strukturDannelsen af LTO@3DC -kompositmaterialet. Kredit:SIAT Dual-ion-batterier (DIBer) bestående af en grafitanode og katode har tiltrukket sig større opmærksomhed på grund af deres fordele ved miljøv
Forskere foreslår nye højtydende dual-ion-batterier med 3-D porøs strukturDannelsen af LTO@3DC -kompositmaterialet. Kredit:SIAT Dual-ion-batterier (DIBer) bestående af en grafitanode og katode har tiltrukket sig større opmærksomhed på grund af deres fordele ved miljøv -
 Svovlindhold i nogle højtydende stoffer svækker dem, når de udsættes for fugtPh.d.-studerende Saiful Hoque ledede ny forskning, der kunne vise vejen til at udvikle stærkere, sikrere beskyttelsestøj til brandmænd og andre arbejdere. Kredit:University of Alberta Forskere har
Svovlindhold i nogle højtydende stoffer svækker dem, når de udsættes for fugtPh.d.-studerende Saiful Hoque ledede ny forskning, der kunne vise vejen til at udvikle stærkere, sikrere beskyttelsestøj til brandmænd og andre arbejdere. Kredit:University of Alberta Forskere har
- Hvilket metal har mere end en oxidationstilstand?
- Hvorfor autonome køretøjer ikke reducerer vores afhængighed af biler i byer
- Udrydde, hvordan planter styrer kvælstofforbruget
- Galileo-satellitter på toppen af raket til næste tirsdags flyvning
- Hvilke bølger har mindst mulig energi?
- Udeladt til tørring:En mere effektiv måde at høste algebiomasse på


