Hvilke beviser er der, at den karakteristiske farve, der er observeret for hver forbindelse på grund af metalion i tilfælde af?
1. D-Orbital opdeling:
* Overgangsmetaller: Overgangsmetaller har delvist fyldt D-orbitaler. Disse D-orbitaler er degenererede (har det samme energiniveau) i et isoleret atom.
* ligandfelt: Når en overgangsmetalion er omgivet af ligander (ioner eller molekyler, der binder til metallet), forårsager ligandernes elektriske felt en opdeling af disse degenererede D-orbitaler til forskellige energiniveauer. Størrelsen af denne opdeling afhænger af ligandernes art og metalion.
2. Elektroniske overgange:
* Absorption af lys: Når en forbindelse absorberer lys, kan en elektron i en lavere energi-d-orbital være begejstret for en højere energi-d-orbital. Energiforskellen mellem disse orbitaler svarer til en bestemt bølgelængde af lys.
* Farveopfattelse: Den farve, vi opfatter, er den komplementære farve på det absorberede lys. For eksempel, hvis en forbindelse absorberer blåt lys, ser vi dets komplementære farve, orange.
Bevis:
* spektroskopiske undersøgelser: UV-VIS-spektroskopi bekræfter absorptionen af specifikke bølgelængder af lys ved overgangsmetalforbindelser, der direkte understøtter D-orbital opdelingsteori.
* farveændring med ligander: Ændring af ligander, der omgiver en metalion, fører ofte til en farveændring på grund af ændret d-orbital opdeling og forskellige bølgelængder af lys absorberet. Dette er grunden til, at forskellige koordinationskomplekser af det samme metal kan have forskellige farver.
* farvevariation inden for en metalserie: Overgangsmetaller i den samme serie (f.eks. Krom, mangan, jern) viser ofte en tendens i farve, hvilket afspejler ændringer i antallet af D-elektroner og de deraf følgende D-orbitale opdelingsmønstre.
Eksempler:
* kobber (ii) ioner: Typisk blå eller grøn på grund af D-D-overgange i Cu (II) ionkomplekset.
* kobolt (II) -ioner: Kan være lyserød, rød eller blå, afhængigt af liganderne, tilskrives igen D-D-overgange.
* nikkel (II) ioner: Ofte grøn, men kan være andre farver afhængigt af liganderne, igen på grund af D-D-overgange.
Sammendrag:
Den karakteristiske farve på en forbindelse, der indeholder en overgangsmetalion, er et resultat af det unikke energiniveau, der opdeles af D-orbitaler forårsaget af liganderne og de efterfølgende elektroniske overgange, der opstår, når lys absorberes. Dette fænomen understøttes af spektroskopiske undersøgelser og de observerede farveændringer baseret på ligander og variation i metalion.
Sidste artikelEr oxalinsyre syntetisk eller naturlig?
Næste artikelHvad vil du gerne, hvilken type reaktioner er 4 AG Plus O2 Arrow 2 AG2O?
 Varme artikler
Varme artikler
-
 Forudsigelse af sekvens fra strukturBindingsgrænsefladen mellem et peptid og dets Bcl-2-proteinmål er sammensat af almindelige strukturelle motiver kendt som TERMer. Kredit:Sebastian Swanson og Avi Singer En måde at undersøge indvik
Forudsigelse af sekvens fra strukturBindingsgrænsefladen mellem et peptid og dets Bcl-2-proteinmål er sammensat af almindelige strukturelle motiver kendt som TERMer. Kredit:Sebastian Swanson og Avi Singer En måde at undersøge indvik -
 At skabe attraktion mellem molekyler dybt i det periodiske systemKredit:CC0 Public Domain Et McGill-ledet internationalt forskerhold giver det første eksperimentelle og teoretiske bevis på, at det er muligt at danne stærke, stabile attraktioner mellem nogle af
At skabe attraktion mellem molekyler dybt i det periodiske systemKredit:CC0 Public Domain Et McGill-ledet internationalt forskerhold giver det første eksperimentelle og teoretiske bevis på, at det er muligt at danne stærke, stabile attraktioner mellem nogle af -
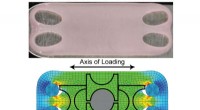 Kunstig brusk under spænding lige så stærk som naturmaterialeBrusk hverken heler eller regenererer efter skade, så kunstig brusk kunne hjælpe mange mennesker med led beskadiget af slid, skade eller sygdom. Lab-dyrket brusk dyrket med spænding (øverst) viser lig
Kunstig brusk under spænding lige så stærk som naturmaterialeBrusk hverken heler eller regenererer efter skade, så kunstig brusk kunne hjælpe mange mennesker med led beskadiget af slid, skade eller sygdom. Lab-dyrket brusk dyrket med spænding (øverst) viser lig -
 Ny antiviral, antibakteriel overflade kan reducere spredning af infektioner på hospitalerKredit:CC0 Public Domain Den nye coronavirus-pandemi har forårsaget en øget efterspørgsel efter antimikrobielle behandlinger, der kan holde overflader rene, især i sundhedsvæsenet. Selvom der er u
Ny antiviral, antibakteriel overflade kan reducere spredning af infektioner på hospitalerKredit:CC0 Public Domain Den nye coronavirus-pandemi har forårsaget en øget efterspørgsel efter antimikrobielle behandlinger, der kan holde overflader rene, især i sundhedsvæsenet. Selvom der er u


