Hvad er densiteten af NO2 -gas ved 0,97 atm og 35 grader Celsius?
1. Forstå den ideelle gaslov
Den ideelle gaslov vedrører tryk (P), volumen (V), antal mol (N), den ideelle gaskonstant (R) og temperatur (T):
PV =NRT
2. Forhold tæthed til mol
Densitet (ρ) er masse (m) pr. Enhedsvolumen (v):
ρ =m/v
Vi kan også udtrykke masse (m) som produktet af mol (n) og molmasse (m):
m =nm
Udskiftning af dette i densitetsligningen:
ρ =(nm)/v
3. Kombiner ligningerne
Omarranger nu den ideelle gaslov til at løse for N/V:
N/V =P/RT
Udskift dette i densitetsligningen:
ρ =(p/rt) * m
4. Tilslut værdierne
* P =0,97 atm
* R =0,0821 l · atm/mol · k (ideel gaskonstant)
* T =35 ° C =308 K (konverter til Kelvin ved at tilføje 273,15)
* M =46,01 g/mol (molmasse på NO2)
5. Beregn tætheden
ρ =(0,97 atm/(0,0821 l · atm/mol · k * 308 k)) * 46,01 g/mol
ρ ≈ 1,77 g/l
Derfor er densiteten af NO2 -gas ved 0,97 atm og 35 ° C ca. 1,77 g/l.
 Varme artikler
Varme artikler
-
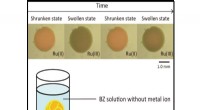 Less is more:En blød, selvbetjent pumpe for at forenkle mekatroniske enhederBelousov-Zhabotinsky hydrogel i opløsning. Kredit:Shibaura Institute of Technology Moderne mekatroniske enheder, fra industrimaskiner til robotter, har set en drastisk stigning i kompleksitet og f
Less is more:En blød, selvbetjent pumpe for at forenkle mekatroniske enhederBelousov-Zhabotinsky hydrogel i opløsning. Kredit:Shibaura Institute of Technology Moderne mekatroniske enheder, fra industrimaskiner til robotter, har set en drastisk stigning i kompleksitet og f -
 Udskiftning af funktionelle grupper med en guldelektrode for at kontrollere et molekyles reaktivitetIBS- og KAIST-forskere brugte guldelektroden og fastgjorde målmolekylerne på elektroden. Ligesom funktionelle grupper genererer forskellige elektroniske effekter, en elektrode passer til alle reaktion
Udskiftning af funktionelle grupper med en guldelektrode for at kontrollere et molekyles reaktivitetIBS- og KAIST-forskere brugte guldelektroden og fastgjorde målmolekylerne på elektroden. Ligesom funktionelle grupper genererer forskellige elektroniske effekter, en elektrode passer til alle reaktion -
 Hurtig test for at påvise salmonella i fødevarerTilfælde af salmonella-madforgiftning er et tilbagevendende fænomen. Råt kød er en hyppig smittekilde. Hvis rundstykket med svinetatar på billedet her var forurenet med patogener, at spise det kan før
Hurtig test for at påvise salmonella i fødevarerTilfælde af salmonella-madforgiftning er et tilbagevendende fænomen. Råt kød er en hyppig smittekilde. Hvis rundstykket med svinetatar på billedet her var forurenet med patogener, at spise det kan før -
 Efterligner naturen for programmerbare og adaptive syntetiske materialerIllustration, der viser skemaet af stimuli kontrolleret levende polymerisation. Kredit:Subi George (subijg@gmail.com) Biologiske systemer er virkelig repræsentative for et komplekst makroskopisk f
Efterligner naturen for programmerbare og adaptive syntetiske materialerIllustration, der viser skemaet af stimuli kontrolleret levende polymerisation. Kredit:Subi George (subijg@gmail.com) Biologiske systemer er virkelig repræsentative for et komplekst makroskopisk f
- Omdannelse af fibriller til krystaller
- Kan kulstofforbindelse til sig selv og andre elementer danne meget store molekylstrukturer?
- Forståelse af sjældne jordarters emulsioner
- Hvor lang tid tager det for månen at krydse himlen fra Moon-Rise Moon-sæt?
- Forskere forklarer de forskellige lugte fra babyer og teenagere
- Intelligent samarbejde om at levere overvågnings- og epidemiske tjenester i smarte byer


