Kan kulstofforbindelse til sig selv og andre elementer danne meget store molekylstrukturer?
Her er grunden til, at kulstof er så speciel:
* stærke og stabile obligationer: Carbon kan danne fire kovalente bindinger med andre atomer, inklusive andre carbonatomer. Dette giver det mulighed for at skabe lange kæder, forgrenede strukturer og ringe.
* forskellige bindingstyper: Carbon kan danne enkelt-, dobbelt- og tredobbeltbindinger med andre atomer, hvilket yderligere øger kompleksiteten af dens molekyler.
* rumlige arrangementer: De fire bindinger omkring et carbonatom kan arrangere sig på forskellige måder, hvilket fører til forskellige former og 3D -strukturer.
Eksempler på store kulstofbaserede molekyler:
* polymerer: Dette er lange kæder til gentagelse af underenheder, som plast, proteiner og kulhydrater. De dannes ofte fra binding af mindre monomerer.
* Biomolekyler: Livets byggesten, inklusive proteiner, DNA og RNA, er store og komplekse kulstofholdige molekyler.
* grafen: Et enkelt lag carbonatomer arrangeret i et honningkaggitter, det er utroligt stærkt og ledende.
* Fullerene: Dette er molekyler af carbonatomer arrangeret i en sfære, ellipsoid eller rørform.
Kulstofens evne til at danne disse store og komplekse strukturer er det, der gør det til rygraden i livet og et afgørende element i mange teknologier.
 Varme artikler
Varme artikler
-
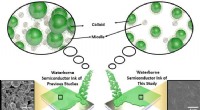 Miljøvenlig vandbåren halvlederblæk ved hjælp af overfladeaktivt stofSammenligning af den vandbårne halvlederblæk i denne undersøgelse og den i de tidligere undersøgelser. Kredit:Daegu Gyeongbuk Institut for Videnskab og Teknologi (DGIST) Et forskerhold fra Energy
Miljøvenlig vandbåren halvlederblæk ved hjælp af overfladeaktivt stofSammenligning af den vandbårne halvlederblæk i denne undersøgelse og den i de tidligere undersøgelser. Kredit:Daegu Gyeongbuk Institut for Videnskab og Teknologi (DGIST) Et forskerhold fra Energy -
 Ekstrem UV -laser viser generering af atmosfærisk forurenende stofEkstrem ultraviolet femtosekund puls lyskilde og fotoelektronspektrometer, nøgleinstrumenter brugt i forsøget. Kredit:Taro Sekikawa En avanceret laserteknik har givet forskere mulighed for at obse
Ekstrem UV -laser viser generering af atmosfærisk forurenende stofEkstrem ultraviolet femtosekund puls lyskilde og fotoelektronspektrometer, nøgleinstrumenter brugt i forsøget. Kredit:Taro Sekikawa En avanceret laserteknik har givet forskere mulighed for at obse -
 Stabilisering af 2-D lagdelte perovskiter til fotovoltaik:Opsætning af en forsvarsmurSammenligning af RP og DJ fase 2D lagdelte perovskit strukturer. Kredit:DICP At opsætte en forsvarsmur i en fodboldkamp er en primær sportsudfordring. Ingen træner kan lide et hul mellem defensive
Stabilisering af 2-D lagdelte perovskiter til fotovoltaik:Opsætning af en forsvarsmurSammenligning af RP og DJ fase 2D lagdelte perovskit strukturer. Kredit:DICP At opsætte en forsvarsmur i en fodboldkamp er en primær sportsudfordring. Ingen træner kan lide et hul mellem defensive -
 Mobiltelefonmikroskop registrerer den tavse dræber af honningbierDemonstration af brugen af den bærbare smartphone-baserede parasitsensor. Kredit:UCLA Engineering Institute for Technology Advancement Bier er blandt de vigtigste arter, der er ansvarlige for at
Mobiltelefonmikroskop registrerer den tavse dræber af honningbierDemonstration af brugen af den bærbare smartphone-baserede parasitsensor. Kredit:UCLA Engineering Institute for Technology Advancement Bier er blandt de vigtigste arter, der er ansvarlige for at
- Elskere og løgnere:Hvor mange sexpartnere har du egentlig haft?
- Hvad er et andet navn på en proteinkæde?
- Hvordan man opbygger dit eget solpanel til fri
- Den genetiske struktur beliggende inden for kernen i hver celle
- Hvorfor udfylder en s orbital før en p orbital?
- Sådan beregnes den oprindelige reaktionshastighed


