Hvad fortæller VSEPR -teorien om et molekyle?
Nøglekoncepter:
* Elektronpar: VSEPR overvejer alle elektronpar omkring et centralt atom, inklusive både bindingspar (involveret i kovalente bindinger) og ensomme par (ikke-bondende elektroner).
* frastødning: Elektronpar afviser hinanden, og de prøver at arrangere sig selv for at minimere denne frastødelse. Dette betyder, at de vil placere sig så langt fra hinanden som muligt.
* Geometri: Arrangementet af elektronpar bestemmer molekylets overordnede form eller geometri.
Hvilken VSEPR -teori fortæller os:
1. Form forudsigelse: VSEPR -teori hjælper os med at forudsige den molekylære geometri (form) af et molekyle. For eksempel fortæller det os, at:
* Et molekyle med to elektronpar omkring det centrale atom vil have en lineær form (f.eks. Becl 2 ).
* Et molekyle med fire elektronpar omkring det centrale atom vil have en tetrahedral form (f.eks. Ch 4 ).
2. obligationsvinkler: VSEPR -teori hjælper med at forudsige de omtrentlige bindingsvinkler mellem atomer i et molekyle. For eksempel i et tetrahedralt molekyle er bindingsvinklerne ca. 109,5 °.
3. Effekter af ensomme par: Enlige par elektroner har en stærkere frastødende virkning end bindingspar. Dette betyder, at molekyler med ensomme par vil have lidt forvrænget geometrier sammenlignet med molekyler med kun bindingspar. For eksempel vand (H 2 O) har to ensomme par på iltatomet, hvilket får H-O-H-bindingsvinklen til at være mindre end 109,5 ° (ca. 104,5 °).
4. Polaritet: VSEPR -teori kan også hjælpe os med at forstå polariteten i et molekyle. Hvis elektronparret er arrangeret asymmetrisk omkring det centrale atom, vil molekylet være polært. Dette betyder, at den ene side af molekylet vil have en delvis positiv ladning, og den anden side vil have en delvis negativ ladning.
Begrænsninger:
Mens VSEPR -teori er et kraftfuldt værktøj til at forudsige molekylformer, har den nogle begrænsninger:
* komplekse molekyler: Det bliver mindre nøjagtigt for større og mere komplekse molekyler, især dem med flere centrale atomer.
* binding: VSEPR tager ikke hensyn til arten af bindingerne (enkelt, dobbelt eller tredobbelt) mellem atomer, hvilket kan påvirke geometrien.
generelt:
VSEPR -teori giver en enkel og nyttig model til forståelse af formerne af molekyler og deres egenskaber. Det er et grundlæggende koncept inden for kemi og bruges i forskellige anvendelser, herunder forståelse af kemiske reaktioner, forudsigelse af fysiske egenskaber og design af nye materialer.
Sidste artikelHvad er anvendelsen af natrium cumene sulfonat?
Næste artikelHvordan er et amorf fast stof relateret til en væske?
 Varme artikler
Varme artikler
-
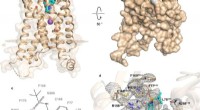 Undersøgelse afslører strukturen af receptor impliceret i type 2 -diabetes og mereFig. 1:Struktur og bindingssted for hBLT1. Kredit:Michaelian, N., et al. Naturkommunikation , https://doi.org/10.1038/s41467-021-23149-1 Forskere fra University of Southern California, Merck &Co
Undersøgelse afslører strukturen af receptor impliceret i type 2 -diabetes og mereFig. 1:Struktur og bindingssted for hBLT1. Kredit:Michaelian, N., et al. Naturkommunikation , https://doi.org/10.1038/s41467-021-23149-1 Forskere fra University of Southern California, Merck &Co -
 En ny måde at fjerne isopbygning uden strøm eller kemikalierFra flyvinger til luftledninger til de gigantiske vinger på vindmøller, en ophobning af is kan forårsage problemer lige fra nedsat ydeevne hele vejen til katastrofale svigt. Men at forhindre den ophob
En ny måde at fjerne isopbygning uden strøm eller kemikalierFra flyvinger til luftledninger til de gigantiske vinger på vindmøller, en ophobning af is kan forårsage problemer lige fra nedsat ydeevne hele vejen til katastrofale svigt. Men at forhindre den ophob -
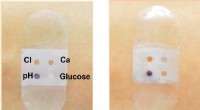 Biosensorbandage opsamler og analyserer svedBiosensorbandage før (venstre) og efter (højre) svedsekretion. Kredit:American Chemical Society Ligesom andre biovæsker, sved indeholder et væld af informationer om, hvad der foregår inde i kroppe
Biosensorbandage opsamler og analyserer svedBiosensorbandage før (venstre) og efter (højre) svedsekretion. Kredit:American Chemical Society Ligesom andre biovæsker, sved indeholder et væld af informationer om, hvad der foregår inde i kroppe -
 Forskere designer en bedre metode til at bygge molekyler, der kunne være lægemidler - i halvdelen …En ny undersøgelse tilbyder en måde at reducere tiden og kræfterne på at lave visse molekyler, der er vigtige for lægemidler. Kredit:University of Chicago Farmaceutiske kemikere har et trick, når
Forskere designer en bedre metode til at bygge molekyler, der kunne være lægemidler - i halvdelen …En ny undersøgelse tilbyder en måde at reducere tiden og kræfterne på at lave visse molekyler, der er vigtige for lægemidler. Kredit:University of Chicago Farmaceutiske kemikere har et trick, når
- Sådan laver du en kerne af jorden som en 3D-model
- Hvilken orientering af hastighed og acceleration vil få noget til at bremse?
- Er bølgelængden i m, hvis en røntgenstråle med en frekvens på 1,5x1018Hz er 0,20?
- Forskere viser, hvordan brandrøg øger ozonforureningen
- Hvilket niveau af organisering er en gruppespilstrows ved havet?
- Accelererer tyngdekraften alle masser i samme hastighed?


