Hvad er reaktionen af natriumaluminat i vand?
1. Hydrolyse:
* Natriumaluminat er meget opløselig i vand, men det gennemgår hydrolyse. Dette betyder, at det reagerer med vandmolekyler til dannelse af aluminiumhydroxid (AL (OH) 3 ) og natriumhydroxid (NaOH):
Naalo 2 (aq) + 2H 2 O (l) ⇌ al (OH) 3 (S) + NaOH (aq)
* Denne reaktion er reversibel, hvilket betyder, at den kan fortsætte i begge retninger afhængigt af betingelserne.
2. Ligevægt og pH:
* Ligevægten af denne reaktion påvirkes af pH. Ved højere pH (mere basale betingelser) favoriserer reaktionen dannelsen af natriumaluminat.
* Ved lavere pH (mere sure betingelser) skifter reaktionen mod dannelsen af aluminiumshydroxid.
3. Udfældning:
* Hydroxid af aluminium er uopløseligt i vand og udfælder ud af opløsningen som et hvidt fast stof.
* Omfanget af nedbør afhænger af den indledende koncentration af natriumaluminat og pH i opløsningen.
4. Dannelse af komplekse ioner:
* I stærkt alkaliske opløsninger er aluminiumsioner (AL 3+ ) kan danne komplekse ioner med hydroxidioner (OH - ), såsom [AL (OH) 4 ] - .
Sammendrag:
Reaktionen af natriumaluminat i vand er en kompleks ligevægtsproces, der involverer hydrolyse, nedbør af aluminiumshydroxid og dannelsen af komplekse ioner. Resultatet af reaktionen afhænger af den indledende koncentration af natriumaluminat og pH i opløsningen.
Bemærk: Natriumaluminat bruges ofte som en kilde til aluminiumshydroxid, der bruges i en række anvendelser, herunder vandbehandling, papirfremstilling og produktion af aluminiumsalte.
Sidste artikelT4 har fire atomer af jod i hvert molekyle?
Næste artikelHvorfor finder du ofte natriumchloridsalt dog ikke metal?
 Varme artikler
Varme artikler
-
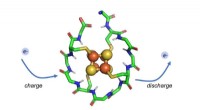 Forskere identificerer protein, der kan have eksisteret, da livet begyndteForskere har designet et syntetisk lille protein, der ombrydes omkring en metalkerne sammensat af jern og svovl. Dette protein kan gentagne gange oplades og udledes, gør det muligt for den at transpor
Forskere identificerer protein, der kan have eksisteret, da livet begyndteForskere har designet et syntetisk lille protein, der ombrydes omkring en metalkerne sammensat af jern og svovl. Dette protein kan gentagne gange oplades og udledes, gør det muligt for den at transpor -
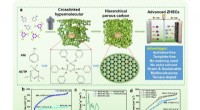 Flerdopet hierarkiske porøse carbonatomer til overlegen zinkionlagring(a) Skematisk illustration af fremstillingsprocesserne for carbonerne og fordelene ved denne metode; (b) nitrogenadsorptions-/desorptionsisotermerne og (c) de tilsvarende porestørrelsesfordelingskurve
Flerdopet hierarkiske porøse carbonatomer til overlegen zinkionlagring(a) Skematisk illustration af fremstillingsprocesserne for carbonerne og fordelene ved denne metode; (b) nitrogenadsorptions-/desorptionsisotermerne og (c) de tilsvarende porestørrelsesfordelingskurve -
 Forskere tager et vigtigt skridt mod kræftbehandlinger, der efterlader sunde celler uskadteForskere har åbnet en mulig vej til nye kræftbehandlinger, der ikke har de bivirkninger, der ofte ledsager mange nuværende kræftbehandlinger ved at identificere en proteinmodifikation, der specifikt u
Forskere tager et vigtigt skridt mod kræftbehandlinger, der efterlader sunde celler uskadteForskere har åbnet en mulig vej til nye kræftbehandlinger, der ikke har de bivirkninger, der ofte ledsager mange nuværende kræftbehandlinger ved at identificere en proteinmodifikation, der specifikt u -
 Formskiftende materiale kan forvandles, vende sig selv ved hjælp af varme, lysKredit:University of Colorado at Boulder Et nyt materiale udviklet af University of Colorado Boulders ingeniører kan forvandle sig til komplekse, forprogrammerede former via lys- og temperaturstim
Formskiftende materiale kan forvandles, vende sig selv ved hjælp af varme, lysKredit:University of Colorado at Boulder Et nyt materiale udviklet af University of Colorado Boulders ingeniører kan forvandle sig til komplekse, forprogrammerede former via lys- og temperaturstim
- Sådan balancerer Redox Equations
- Langvarige eksperimenter når 1, 000. dag
- Vandforurening ødelægger Iraks olierige syd
- Kemiske reaktioner bryder fri fra energibarrierer ved at bruge flyby-baner
- Hvis en syre ikke opløses let i vand, hvad vil du gøre for at løse dette problem?
- Flod af 'skrammel':Hvordan AI ændrer videnskabelig udgivelse


