Svovldioxid er ikke ideelt ikke ideelt ved 273k, men opfører sig ideelt 327C.explain det?
Faktorer, der påvirker ideel gasadfærd:
* Intermolekylære kræfter: Ideelle gasser antages at have ubetydelige intermolekylære kræfter. Imidlertid oplever reelle gasser som SO2 attraktive kræfter (van der Waals kræfter) mellem molekyler. Disse kræfter bliver mere markante ved lavere temperaturer og højere tryk, hvilket forårsager afvigelser fra ideel opførsel.
* molekylær volumen: Ideelle gasser antages at have nul molekylær volumen. I virkeligheden optager molekyler plads, og dette volumen bliver mere markant ved højere tryk.
Forklaring på SO2:
* ved 273 K: Ved denne relativt lave temperatur er de intermolekylære kræfter mellem SO2 -molekyler stærkere. Disse kræfter får molekylerne til at afvige fra de ideelle gasforudsætninger, hvilket fører til ikke-ideel opførsel.
* ved 327 ° C: Ved denne højere temperatur har molekylerne signifikant mere kinetisk energi. Denne øgede kinetiske energi overvinder de intermolekylære kræfter, hvilket gør det muligt for molekylerne at opføre sig mere som ideelle gasser. Derudover reducerer den øgede temperatur den relative betydning af molekylærvolumen sammenlignet med det tilgængelige rum.
Nøglepunkter:
* Ægte gasser nærmer sig ideel adfærd ved højere temperaturer og lavere tryk: Dette skyldes, at virkningerne af intermolekylære kræfter og molekylvolumen på disse forhold bliver mindre signifikante.
* Svovldioxid er et polært molekyle: Dens polære natur bidrager til stærkere intermolekylære kræfter, hvilket yderligere forbedrer dens ikke-ideelle opførsel ved lavere temperaturer.
Kortfattet: Svovldioxid udviser ikke-ideel opførsel ved 273 K på grund af stærke intermolekylære kræfter og den relative betydning af molekylvolumen ved denne temperatur. Ved 327 ° C minimeres disse effekter, hvilket fører til mere ideel opførsel.
 Varme artikler
Varme artikler
-
 En havændring for plastikforurening:nyt materiale nedbrydes biologisk i havvandEn bæredygtig Blueview-sko nedbrydes biologisk i havvand efter 11 uger. Kredit:Daniel Zhen, Algenesis Inc. Plast, der nu er allestedsnærværende i den moderne verden, er blevet en stigende trussel m
En havændring for plastikforurening:nyt materiale nedbrydes biologisk i havvandEn bæredygtig Blueview-sko nedbrydes biologisk i havvand efter 11 uger. Kredit:Daniel Zhen, Algenesis Inc. Plast, der nu er allestedsnærværende i den moderne verden, er blevet en stigende trussel m -
 Ny bøjelig cementfri beton kan potentielt gøre sikrere, langtidsholdbar og grønnere infrastrukturFig. 1. Typiske flere hårstørrelser revner i vores bøjelige cementfri beton, når de udsættes for trækbelastning (dvs. bliver strakt). Kredit:Swinburne University of Technology En ny type beton, de
Ny bøjelig cementfri beton kan potentielt gøre sikrere, langtidsholdbar og grønnere infrastrukturFig. 1. Typiske flere hårstørrelser revner i vores bøjelige cementfri beton, når de udsættes for trækbelastning (dvs. bliver strakt). Kredit:Swinburne University of Technology En ny type beton, de -
 Maskinindlæring revner krystalstrukturenes oxidationstilstandeKredit:CC0 Public Domain Kemiske grundstoffer udgør stort set alt i den fysiske verden. Fra 2016 vi kender til 118 elementer, som alle kan findes kategoriseret i det berømte periodiske system, der
Maskinindlæring revner krystalstrukturenes oxidationstilstandeKredit:CC0 Public Domain Kemiske grundstoffer udgør stort set alt i den fysiske verden. Fra 2016 vi kender til 118 elementer, som alle kan findes kategoriseret i det berømte periodiske system, der -
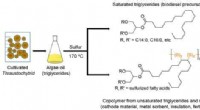 Simpel metode til at udvinde bioaktive stoffer af høj værdi fra encellet algeolieGrafisk abstrakt. Kredit:ACS Sustainable Chemistry &Engineering (2022). DOI:10.1021/acssuschemeng.1c08139 For at redde verdens fiskebestande og oceaner ræser forskere for at finde bedre og bæredygt
Simpel metode til at udvinde bioaktive stoffer af høj værdi fra encellet algeolieGrafisk abstrakt. Kredit:ACS Sustainable Chemistry &Engineering (2022). DOI:10.1021/acssuschemeng.1c08139 For at redde verdens fiskebestande og oceaner ræser forskere for at finde bedre og bæredygt
- Hvad er arrangementet af molekyler noget?
- Undersøgelse identificerer de mest metalfattige stjerner i Omega Centauri-hoben
- Den kinetiske energi af et objekt er lig med den ene halv masse ganget med dens hastighed?
- Skolelukninger sidebeskæftiger sig med arbejdende mødre
- Team identificerer universalitet og specificitet i proteinbevægelser
- Hvad er forskellen mellem 28C og 25C?


