Hvordan er ioniske forbindelser navngivet?
1. Kationer (positivt ladede ioner)
* Metaller: Navnet på metallet bruges direkte.
* Eksempel:natrium (Na+)
* ikke -metaller: Brug elementnavnet med suffikset "-ium"
* Eksempel:Ammonium (NH4+)
* variable opladningsmetaller: Romertal bruges i parentes efter metalnavnet for at indikere dets ladning.
* Eksempel:jern (II) (Fe2+), jern (III) (Fe3+)
2. Anioner (negativt ladede ioner)
* ikke -metaller: Brug elementnavnet med suffikset "-ide".
* Eksempel:Chlorid (cl-), oxid (O2-)
* polyatomiske ioner: Disse har specielle navne, som du bliver nødt til at huske.
* Eksempel:sulfat (SO42-), carbonat (CO32-)
at sætte det sammen:navngivende ioniske forbindelser
1. Skriv først kationen, derefter anionen.
2. Hvis metallet har en variabel ladning, skal du angive dets ladning med et romantal.
3.
Eksempler:
* NaCl: Natriumchlorid (natrium har en +1 ladning, chlorid har en -1 -ladning)
* cao: Calciumoxid (calcium har en +2 ladning, oxid har en -2 ladning)
* fecl2: Jern (II) Chlorid (jern har en +2 ladning, chlorid har en -1 -ladning)
* AL2 (SO4) 3: Aluminiumsulfat (aluminium har en +3 ladning, sulfat har en -2 ladning)
Nøglepunkter:
* ioniske forbindelser er elektrisk neutrale. Anklagerne for kationerne og anionerne skal afbalancere.
* Memoriser almindelige polyatomiske ioner. Der er nogle vigtige polyatomiske ioner, som du ofte støder på.
* praksis! Den bedste måde at lære at navngive ioniske forbindelser er at øve med eksempler.
Fortæl mig, hvis du gerne vil have nogle flere eksempler eller have en bestemt forbindelse, du vil navngive!
 Varme artikler
Varme artikler
-
 Brækker rumaffald nogensinde naturligt ned? (video)Kan du huske, da Elon Musk sendte en bil ud i rummet? Den bil driver ikke bare fredeligt gennem et vakuum – den suser rundt om solen med 63.592 miles i timen og bliver bombarderet af solstråling. Det
Brækker rumaffald nogensinde naturligt ned? (video)Kan du huske, da Elon Musk sendte en bil ud i rummet? Den bil driver ikke bare fredeligt gennem et vakuum – den suser rundt om solen med 63.592 miles i timen og bliver bombarderet af solstråling. Det -
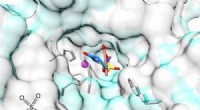 Kunstigt sødemiddel kunne en dag give kræftbehandlinger med færre bivirkningerKredit:American Chemical Society Kunstige sødestoffer bruges i diætdrikke og fødevarer, men kan også en dag bruges som behandlinger rettet mod kulsyreanhydrase IX (CA IX), et protein forbundet med
Kunstigt sødemiddel kunne en dag give kræftbehandlinger med færre bivirkningerKredit:American Chemical Society Kunstige sødestoffer bruges i diætdrikke og fødevarer, men kan også en dag bruges som behandlinger rettet mod kulsyreanhydrase IX (CA IX), et protein forbundet med -
 Forskere foreslår ny koblingsstrategi for organisk spildevandsrensningGrafisk abstrakt. Kredit:Anvendt katalyse B:Miljø (2022). DOI:10.1016/j.apcatb.2022.121858 En fælles forskergruppe ledet af prof. Sun Chenglin, prof. Wei Huangzhao og prof. Li Rengui fra Dalian Ins
Forskere foreslår ny koblingsstrategi for organisk spildevandsrensningGrafisk abstrakt. Kredit:Anvendt katalyse B:Miljø (2022). DOI:10.1016/j.apcatb.2022.121858 En fælles forskergruppe ledet af prof. Sun Chenglin, prof. Wei Huangzhao og prof. Li Rengui fra Dalian Ins -
 Litauere udvikler en takeaway-madpakke, der er fuldstændig plastikfriKaunas borgere, forskere og virksomheder skabte en innovativ madpakke med madpakke under en fælles workshop. Kredit:KTU Takeaway mad er blevet en integreret del af vores liv. På trods af bekvemmeli
Litauere udvikler en takeaway-madpakke, der er fuldstændig plastikfriKaunas borgere, forskere og virksomheder skabte en innovativ madpakke med madpakke under en fælles workshop. Kredit:KTU Takeaway mad er blevet en integreret del af vores liv. På trods af bekvemmeli


