Nogle kovalente forbindelser adskiller sig i ioner, når de opløses i vand 1 Hvad atomer gør disse har deres struktur 2 type vandig opløsningsform 3 giver f.eks. 2?
kovalente forbindelser, der adskiller sig i vand
Her er en sammenbrud af kovalente forbindelser, der adskiller sig i vand sammen med eksempler:
1. Involverede atomer og struktur:
Disse forbindelser involverer typisk:
* stærkt elektronegative atomer: Såsom ilt (O), nitrogen (N), chlor (CL), fluor (F) eller brom (BR).
* polære kovalente obligationer: Disse bindinger dannes, når elektroner deles ulige mellem atomer på grund af en signifikant forskel i elektronegativitet. Dette skaber en delvis positiv ladning (Δ+) på det ene atom og en delvis negativ ladning (Δ-) på den anden.
2. Type vandig opløsning dannet:
Når disse kovalente forbindelser opløses i vand, danner de ioniske opløsninger . De polære vandmolekyler interagerer med de ladede ender af det kovalente molekyle, trækker molekylet fra hinanden og danner ioner.
3. Eksempler:
Her er to eksempler på kovalente forbindelser, der adskiller sig i ioner, når de opløstes i vand:
* hydrogenchlorid (HCL):
* Struktur:H-CL (polær kovalent binding med en delvis positiv ladning på brint og en delvis negativ ladning på klor).
* Dissociation:HCL (G) + H₂O (L) → H₃O⁺ (AQ) + CL⁻ (AQ)
* Opløsningen er sur på grund af dannelsen af hydroniumioner (H₃O⁺).
* ammoniak (NH₃):
* Struktur:N-H-bindinger (polære kovalente bindinger med en delvis negativ ladning på nitrogen og en delvis positiv ladning på brint).
* Dissociation:NH₃ (G) + H₂O (L) ⇌ NH₄⁺ (aq) + OH⁻ (aq)
* Opløsningen er grundlæggende på grund af dannelsen af hydroxidioner (OH⁻).
Nøglepunkt: Ikke alle kovalente forbindelser adskiller sig i ioner i vand. Kun dem med meget polære bindinger og en stærk interaktion med vandmolekyler gennemgår denne proces.
 Varme artikler
Varme artikler
-
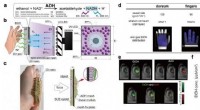 At se det usynlige – Et nyt gasbilleddannelsessystem(a) Detektionsprincip for EtOH baseret på den ADH-medierede katalytiske reaktion. (b) Skematisk diagram af skin-gas-kammen. (c) Arbejdsmekanisme af todimensionel (2D) Mako. (d) Sammenfatning af svedha
At se det usynlige – Et nyt gasbilleddannelsessystem(a) Detektionsprincip for EtOH baseret på den ADH-medierede katalytiske reaktion. (b) Skematisk diagram af skin-gas-kammen. (c) Arbejdsmekanisme af todimensionel (2D) Mako. (d) Sammenfatning af svedha -
 Hvor bliver surt øl så... surtØlprøver (til højre) blev indsamlet hver 2.-3. uge for at spore skiftende koncentrationer af organiske syrer og sporkomponenter under lagring i tønder (venstre). Kredit:Bryan Doty/Sour Cellars sur
Hvor bliver surt øl så... surtØlprøver (til højre) blev indsamlet hver 2.-3. uge for at spore skiftende koncentrationer af organiske syrer og sporkomponenter under lagring i tønder (venstre). Kredit:Bryan Doty/Sour Cellars sur -
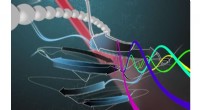 Hurtig screeningsmaskine kan læse og adskille proteinsekvenserKunstnere gengivelse af sorteringsprocessen for molekyler i Bio-Enigma maskinen. Ultrahurtig laser-probing spektroskopi afslører proteiners molekylære struktur. Kredit:Nasim Motalebi De strukturel
Hurtig screeningsmaskine kan læse og adskille proteinsekvenserKunstnere gengivelse af sorteringsprocessen for molekyler i Bio-Enigma maskinen. Ultrahurtig laser-probing spektroskopi afslører proteiners molekylære struktur. Kredit:Nasim Motalebi De strukturel -
 Undersøgelse af salte i vand, der forårsager røreEt forskerhold ledet af Argonnes Giulia Galli har fået ny indsigt om saltvands struktur ved at simulere væsken på molekylært niveau med Mira-supercomputeren, placeret på Argonne Leadership Computing F
Undersøgelse af salte i vand, der forårsager røreEt forskerhold ledet af Argonnes Giulia Galli har fået ny indsigt om saltvands struktur ved at simulere væsken på molekylært niveau med Mira-supercomputeren, placeret på Argonne Leadership Computing F
- Hvordan ændrer en raket sin hastighed i rummet?
- En spin-bølge-detektivhistorie:Forskere bekræfter overraskende adfærd i en 2-D-magnet
- Hvad kaldes en organisk forbindelse, der bruges til at opbevare energi og danner vigtige dele af bio…
- Forskere designer Triple Quantum Dot til Quantum Information Applications
- Hvilken planet er den mest fjerne synlige for nøgne øje?
- Hurtig laseropløsning til fasehentningsproblemet


