Når natriummetal anbringes i et bægerglas af vandhydrogengas og hydroxidopløsning dannes?
reaktionen
Når natriummetal (NA) anbringes i vand (H₂O), gennemgår det en kraftig reaktion for at producere brintgas (H₂) og natriumhydroxid (NaOH) opløsning.
Kemisk ligning:
2 NA (S) + 2 H₂O (L) → 2 NaOH (AQ) + H₂ (G)
Forklaring:
1. Natriums reaktivitet: Natrium er et meget reaktivt alkalimetal. Det mister let sit ydre elektron for at blive en positivt ladet ion (Na⁺).
2. Vands rolle: Vandmolekyler er polære, hvilket betyder, at de har en let positiv ladning på brintsiden og en let negativ ladning på iltsiden. Dette gør det muligt for vand at interagere med natriumionerne.
3. reaktionsproces:
* Natriumatomet mister sit elektron til et vandmolekyle og danner en natriumion (Na⁺).
* Elektronet fra natriumatomet fastgøres til et hydrogenatom i vandmolekylet og danner et brintatom (H).
* To hydrogenatomer kombineres for at danne et hydrogenmolekyle (H₂), der frigives som en gas.
* Den resterende hydroxidion (OH⁻) kombineres med natriumionen for at danne natriumhydroxid (NaOH), der opløses i vandet for at danne en opløsning.
Observationer:
* kraftig reaktion: Reaktionen er meget eksoterm, hvilket betyder, at den frigiver varme. Du vil observere en masse boblende, fizzing og varme.
* brintgasudvikling: Du kan se brintgas blive frigivet som bobler.
* Løsningsdannelse: Natriumhydroxid opløses i vandet og skaber en klar, farveløs opløsning.
Vigtig sikkerhed Bemærk: Dette er en meget farlig reaktion. Natrium reagerer eksplosivt med vand, og reaktionen kan generere betydelig varme og potentielt brandfarlig brintgas. Forsøg aldrig dette eksperiment uden korrekt sikkerhedsudstyr og tilsyn fra en kvalificeret kemiker.
 Varme artikler
Varme artikler
-
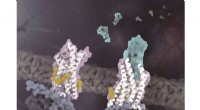 Kemokinreceptor CX3CR1-strukturer afslører mekanisme for kolesterolregulering ved aktiveringStrukturerne af CX3CR1 i distinkte konformationelle tilstande. CX3CR1 i både ligandfri tilstand og CX3CL1-bundet tilstand er farvet hvid. CX3CL1 er farvet cyan, kolesterolerne er farvet gule og de tre
Kemokinreceptor CX3CR1-strukturer afslører mekanisme for kolesterolregulering ved aktiveringStrukturerne af CX3CR1 i distinkte konformationelle tilstande. CX3CR1 i både ligandfri tilstand og CX3CL1-bundet tilstand er farvet hvid. CX3CL1 er farvet cyan, kolesterolerne er farvet gule og de tre -
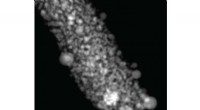 Ny elektrokatalysator udkonkurrerer platin i produktionen af alkalisk brintDen nye katalysator er et nanostruktureret kompositmateriale sammensat af carbon nanotråde med rutheniumatomer bundet til nitrogen og carbon for at danne aktive steder i carbonmatrixen. Elektronmikros
Ny elektrokatalysator udkonkurrerer platin i produktionen af alkalisk brintDen nye katalysator er et nanostruktureret kompositmateriale sammensat af carbon nanotråde med rutheniumatomer bundet til nitrogen og carbon for at danne aktive steder i carbonmatrixen. Elektronmikros -
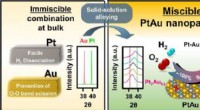 Direkte syntese af hydrogenperoxid med en platin-guld nanopartikelkatalysatorGuld-platin nanopartikel komposit skematisk. Kredit:Korea Institute of Science and Technology (KIST) Hydrogenperoxid fortyndet i vand bruges som desinfektionsmiddel til behandling af sår. Det er m
Direkte syntese af hydrogenperoxid med en platin-guld nanopartikelkatalysatorGuld-platin nanopartikel komposit skematisk. Kredit:Korea Institute of Science and Technology (KIST) Hydrogenperoxid fortyndet i vand bruges som desinfektionsmiddel til behandling af sår. Det er m -
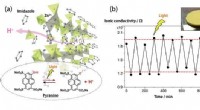 Styring af protonledning med lysFigur. (a) Krystalstruktur af H+ ledende koordinationspolymer og doteret pyraninmolekyle, som frigiver/fanger H+ ved lysbestråling. (b) Observeret H+ konduktivitetsskifteegenskab ved tænd/sluk lysbest
Styring af protonledning med lysFigur. (a) Krystalstruktur af H+ ledende koordinationspolymer og doteret pyraninmolekyle, som frigiver/fanger H+ ved lysbestråling. (b) Observeret H+ konduktivitetsskifteegenskab ved tænd/sluk lysbest
- Hvad er indsatsen i en simpel maskine?
- Hvilken slags forvitring ændrer kompositionen en klippe?
- Rødt tidevand fortsætter med at sprede sig omkring det sydvestlige Florida
- Porsche trodser uroligheder, og Porsche går for fuld gas med stor succes-børsnotering
- Ikke så simpel tanke:Hvordan bakterier danner membranvesikler
- Hvorfor er oversvømmelser i Sydafrikas KwaZulu-Natal så ødelæggende? Byplanekspert forklarer


