Hvor mange ml vand er nødvendige for at fremstille en 0,171 m opløsning, der indeholder 1,00 g NaCl?
1. Beregn molen af NaCl:
* Molær masse af NaCl: 58,44 g/mol
* mol NaCl: (1,00 g NaCl) / (58,44 g / mol) =0,0171 mol NaCl
2. Beregn mængden af løsning:
* Molaritet (M): 0,171 mol/l
* volumen (L): (0,0171 mol NaCl) / (0,171 mol / L) =0,1 L
* volumen (ml): 0,1 L * 1000 ml/l =100 ml
Derfor har du brug for 100 ml vand for at fremstille en 0,171 m opløsning indeholdende 1,00 g NaCl.
Vigtig note: Denne beregning antager, at mængden af NaCl er ubetydelig sammenlignet med vandmængden. I virkeligheden vil tilføjelse af NaCl lidt øge det samlede volumen af opløsningen lidt. For meget koncentrerede løsninger kan denne forskel være betydelig, men for dette specifikke tilfælde er antagelsen rimelig.
Sidste artikelHvad er oxidationstilstanden i gruppe 13?
Næste artikelHvordan skriver du formel til lithiumiodid?
 Varme artikler
Varme artikler
-
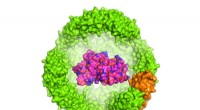 Forskere folder et protein i et proteinIllustration af et protein af interesse (POI) inde i en 24-underenhed Archeoglobus fulgidus ferritin exoshell, som er 12 nanometer i diameter (kun halvdelen af skallen er vist). Kredit:Dr. Chester L
Forskere folder et protein i et proteinIllustration af et protein af interesse (POI) inde i en 24-underenhed Archeoglobus fulgidus ferritin exoshell, som er 12 nanometer i diameter (kun halvdelen af skallen er vist). Kredit:Dr. Chester L -
 Ren teknologi til fremstilling af lavmolekylær chitosanPlasma-assisteret depolymerisation af chitosan i en kvartsblandingsanordning. Kredit:MIPT Forskere ved MIPT har udviklet en ny teknik til at opnå lavmolekylær vægt, vandopløseligt kitin og chitosa
Ren teknologi til fremstilling af lavmolekylær chitosanPlasma-assisteret depolymerisation af chitosan i en kvartsblandingsanordning. Kredit:MIPT Forskere ved MIPT har udviklet en ny teknik til at opnå lavmolekylær vægt, vandopløseligt kitin og chitosa -
 Jern-medieret kræftcelle aktivitet:En ny reguleringsmekanismeMesenkymale stamceller (til højre) er forbundet med metastatisk spredning, modstandsdygtighed over for konventionel kemoterapi og tilbagefald. Under overgangen til denne tilstand, proteinet CD44 overt
Jern-medieret kræftcelle aktivitet:En ny reguleringsmekanismeMesenkymale stamceller (til højre) er forbundet med metastatisk spredning, modstandsdygtighed over for konventionel kemoterapi og tilbagefald. Under overgangen til denne tilstand, proteinet CD44 overt -
 Et origami-inspireret medicinsk plaster til forsegling af indre skaderMIT-ingeniører har designpapirlignende medicinske tape (vist her), der kan foldes rundt om kirurgiske værktøjer og forvandles til bløde, stærke klæbemidler, når de presses mod væv. Kredit:Felice Frank
Et origami-inspireret medicinsk plaster til forsegling af indre skaderMIT-ingeniører har designpapirlignende medicinske tape (vist her), der kan foldes rundt om kirurgiske værktøjer og forvandles til bløde, stærke klæbemidler, når de presses mod væv. Kredit:Felice Frank
- Hvilken havstrøm bærer køligt vand mod jord ækvator?
- The Cotton Gin:Eli Whitney og indvirkningen på den amerikanske økonomi
- Langtidssvingninger styrer solens differentielle rotation:Undersøgelse
- Design af undervandskøretøjer inspireret af fiskeskoler
- Hvordan adskiller du jernfyldninger fra svovl?
- Hvordan ligner potentiel energi kinetisk energi?


