Identificer antallet af overskydende reagens, der er tilbage, når 8.368 jern III -oxid reageres med 9.825 aluminium i termitreaktion.?
1. Skriv den afbalancerede kemiske ligning:
Termitreaktionen er:
Fe₂o₃ (S) + 2 Al (S) → 2 Fe (L) + Al₂o₃ (S)
2. Beregn mol af reaktanter:
* mol Fe₂o₃:
- Molmasse af Fe₂o₃ =159,69 g/mol
- mol =(8,368 g) / (159,69 g / mol) =0,0524 mol
* mol Al:
- Molmasse Al =26,98 g/mol
- mol =(9,825 g) / (26,98 g / mol) =0,364 mol
3. Bestem den begrænsende reaktant:
- Fra den afbalancerede ligning reagerer 1 mol Fe₂o₃ med 2 mol Al.
- Molforholdet mellem Fe₂o₃ og Al er 1:2.
- For den givne mængde Fe₂o₃ (0,0524 mol) har vi brug for 0,0524 mol * 2 =0,1048 mol Al.
- Vi har mere AL (0,364 mol) end vi har brug for. Derfor er fe₂o₃ den begrænsende reaktant.
4. Beregn mol af overskydende reaktant (AL) forbruges:
- Da Fe₂o₃ er den begrænsende reaktant, bestemmer den, hvor meget Al reagerer.
- Fra den afbalancerede ligning reagerer 1 mol Fe₂o₃ med 2 mol Al.
- Så 0,0524 mol Fe₂o₃ reagerer med 0,0524 mol * 2 =0,1048 mol al.
5. Beregn mol af overskydende reaktant (AL) resterende:
- indledende mol Al - mol forbruges =mol resterende
- 0,364 mol - 0,1048 mol =0,2592 mol
Svar: Der er 0,2592 mol af aluminium tilbage efter reaktionen.
 Varme artikler
Varme artikler
-
 Forskere opdager ny teknik til at teste for virusinfektionerBrian Geiss holder en wire, der er en fjerdedel af størrelsen af et menneskehår. Kredit:John Eisele/ CSU Photography Et hold forskere fra Colorado State University har udviklet teknologi, der ka
Forskere opdager ny teknik til at teste for virusinfektionerBrian Geiss holder en wire, der er en fjerdedel af størrelsen af et menneskehår. Kredit:John Eisele/ CSU Photography Et hold forskere fra Colorado State University har udviklet teknologi, der ka -
 Forskning bekræfter, at opvarmning kan øge styrken af en type hydrogelKredit:Australian Nuclear Science and Technology Organization (ANSTO) Små vinkelneutronspredning (SANS) ved Australian Center for Neutron Scattering har bekræftet, at styrken af en type supramol
Forskning bekræfter, at opvarmning kan øge styrken af en type hydrogelKredit:Australian Nuclear Science and Technology Organization (ANSTO) Små vinkelneutronspredning (SANS) ved Australian Center for Neutron Scattering har bekræftet, at styrken af en type supramol -
 Antibakterielt aktivt tøj? Påstanden er lige så absurd, som den lyderKredit:Shutterstock Lorna Jane lancerede for nylig en antiviral serie af sit aktive tøj, kaldet LJ Shield, skaber betydelig modreaktion fra læger. Det populære activewear -mærke har nu trådt tilb
Antibakterielt aktivt tøj? Påstanden er lige så absurd, som den lyderKredit:Shutterstock Lorna Jane lancerede for nylig en antiviral serie af sit aktive tøj, kaldet LJ Shield, skaber betydelig modreaktion fra læger. Det populære activewear -mærke har nu trådt tilb -
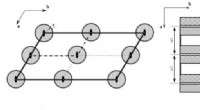 En ny klassificering af symmetrigrupper i krystalrummet foreslået af russiske videnskabsmændForbudt volumen i todimensionelle rumsymmetrigrupper:(venstre) p2 og (højre) pm. Bølget fyldning angiver forbudte områder. Kredit:Lobachevsky University Det indbyrdes arrangement af atomer i kryst
En ny klassificering af symmetrigrupper i krystalrummet foreslået af russiske videnskabsmændForbudt volumen i todimensionelle rumsymmetrigrupper:(venstre) p2 og (højre) pm. Bølget fyldning angiver forbudte områder. Kredit:Lobachevsky University Det indbyrdes arrangement af atomer i kryst
- Genovervej miljøregler i Afrika, studietrang
- Cassinis leder efter byggestenene i livet på Titan
- En ingeniør foreslår en ny model for måden, hvorpå mennesker lokaliserer lyde
- Hvad er pH-værdien af HCl?
- Hvor kommer ATP og NADPH i Calvin -cyklus fra?
- Forskning viser meningsmålere, hvordan de uafklarede vil stemme


