Hvad er pH på en 0,440 IT m ammoniakopløsning?
1. Forstå ammoniaks egenskaber
* Ammoniak er en svag base, hvilket betyder, at den ikke ioniseres i vand.
* Ligevægtsreaktionen for ammoniak i vand er:
NH₃ (aq) + H₂O (L) ⇌ NH₄⁺ (aq) + OH⁻ (aq)
2. Brug KB -værdien
* Basisioniseringskonstanten (KB) for ammoniak er 1,8 x 10⁻⁵. Denne værdi fortæller os, i hvilket omfang ammoniak iiniserer i vand.
3. Opret et isbord
| | NH₃ | NH₄⁺ | Oh⁻ |
| ----- | -------- | -------- | -------- |
| I | 0,440 | 0 | 0 |
| C | -x | +x | +x |
| E | 0,440-x | X | X |
* i (Initial):Vi starter med 0,440 m ammoniak og ingen produkter.
* C (Ændring):Reaktionen skifter til højre, forbruger ammoniak og danner produkter.
* e (Ligevægt):Vi repræsenterer ændringen i koncentration med 'X'.
4. Skriv KB -udtrykket
KB =[NH₄⁺] [OH⁻] / [NH₃]
5. Erstatte og løse for x
1,8 x 10⁻⁵ =(x) (x) / (0,440 - x)
* Da KB er lille, kan vi antage, at 'X' er meget mindre end 0,440, så vi kan forenkle ligningen:
1,8 x 10⁻⁵ ≈ x²/0,440
* Løs for x:
x² ≈ 7,92 x 10⁻⁶
x ≈ 2,81 x 10⁻³ m
6. Beregn POH
poh =-log [oh⁻] =-log (2,81 x 10⁻³) ≈ 2,55
7. Beregn pH
Ph + POH =14
pH =14 - POH ≈ 14 - 2,55 ≈ 11.45
Derfor er pH på en 0,440 m ammoniakopløsning ca. 11,45.
Sidste artikelKoncentrationen på 58,5 g NaCI i 2 L opløsning?
Næste artikelFordele og ulemper ved ikke -jernholdige metaller?
 Varme artikler
Varme artikler
-
 Virushydrofobicitet kan hjælpe med at rense vaccinerDen vandafvisende skal af proteiner, der danner kapsiden af et porcint parovirus, var fokus for Caryn Heldts undersøgelse. Kredit:Michigan Technological University En person behøver ikke at bliv
Virushydrofobicitet kan hjælpe med at rense vaccinerDen vandafvisende skal af proteiner, der danner kapsiden af et porcint parovirus, var fokus for Caryn Heldts undersøgelse. Kredit:Michigan Technological University En person behøver ikke at bliv -
 Udnytter kraften i CRISPR-Cas9 til at vække antibiotika fra deres tavse genklyngerLille forstyrrelse, stor indvirkning:Antibiotikum, auroramycin, blev vækket gennem CRISPR-Cas9-promotorens knock-in-strategi. Kredit:A*STAR Institute of Chemical and Engineering Sciences Bakterien
Udnytter kraften i CRISPR-Cas9 til at vække antibiotika fra deres tavse genklyngerLille forstyrrelse, stor indvirkning:Antibiotikum, auroramycin, blev vækket gennem CRISPR-Cas9-promotorens knock-in-strategi. Kredit:A*STAR Institute of Chemical and Engineering Sciences Bakterien -
 De stiveste porøse letvægtsmaterialer nogensindePladegitter er det valgmæssige design til fremtidige lette porøse materialer. Kredit:ETH Zürich / Marc Day Forskere ved ETH har udviklet og fremstillet en familie af arkitekturer, der maksimerer s
De stiveste porøse letvægtsmaterialer nogensindePladegitter er det valgmæssige design til fremtidige lette porøse materialer. Kredit:ETH Zürich / Marc Day Forskere ved ETH har udviklet og fremstillet en familie af arkitekturer, der maksimerer s -
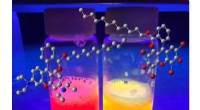 Lab producerer simple fluorescerende overfladeaktive stofferRice University kemikere har produceret en række fluorescerende overfladeaktive stoffer til billeddannelse, biomedicinske og fremstillingsapplikationer. Kredit:Ashleigh Smith McWilliams/Rice Universit
Lab producerer simple fluorescerende overfladeaktive stofferRice University kemikere har produceret en række fluorescerende overfladeaktive stoffer til billeddannelse, biomedicinske og fremstillingsapplikationer. Kredit:Ashleigh Smith McWilliams/Rice Universit
- Før månelanding, astronauter lærte geologi i Arizona (Opdatering)
- Hvilke typer sedimenter er i jord, som er mest almindelige ørkenjord?
- Første magneter til FAIR testet på CERN
- Kobolt rammer overskrifter, da Glencore lukker nøgleminen
- Hvor langt er stjernerne fra solen?
- International indsats afslører 157 dages cyklus i usædvanlige kosmiske radioudbrud


