En katalysator øger hastigheden for en kemisk reaktion ved at ændre hvilke følgende forhold?
Her er hvorfor:
* Aktiveringsenergi: Dette er den mindste mængde energi, der kræves for molekyler at reagere. Tænk på det som "pukkel" et molekyle skal klatre for at komme over for at blive et produkt.
* katalysatorens rolle: En katalysator giver en alternativ reaktionsvej med en lavere aktiveringsenergi. Dette betyder, at molekylerne har brug for mindre energi for at reagere, hvilket fører til en hurtigere reaktionshastighed.
Nøglepunkter:
* Katalysatorer forbruges ikke i reaktionen. De letter simpelthen reaktionen.
* Katalysatorer ændrer ikke reaktionens ligevægtsposition. De fremskynder kun den hastighed, hvormed ligevægt er nået.
Fortæl mig, hvis du gerne vil have flere detaljer om, hvordan katalysatorer fungerer!
 Varme artikler
Varme artikler
-
 Enhed forvandler skaller af havdyr til kraft til medicinsk, augmented reality, mobiltelefonenhederEt Purdue-team er ved at omdanne rejeskalmateriale til en funktionel enhed til at generere elektricitet. Kredit:Purdue University En innovation, der bruger materiale, der stammer fra skaller fra k
Enhed forvandler skaller af havdyr til kraft til medicinsk, augmented reality, mobiltelefonenhederEt Purdue-team er ved at omdanne rejeskalmateriale til en funktionel enhed til at generere elektricitet. Kredit:Purdue University En innovation, der bruger materiale, der stammer fra skaller fra k -
 Med en flerlags tilgang, et filter, der opfylder ferskvandsforsyningsbehovetKredit:Pixabay/CC0 Public Domain På jagt efter en bedre måde at afsaltes vand på, et Yale-ledet team af forskere har vendt sig til badedragtmateriale for inspiration. Omvendt osmose, som bruger m
Med en flerlags tilgang, et filter, der opfylder ferskvandsforsyningsbehovetKredit:Pixabay/CC0 Public Domain På jagt efter en bedre måde at afsaltes vand på, et Yale-ledet team af forskere har vendt sig til badedragtmateriale for inspiration. Omvendt osmose, som bruger m -
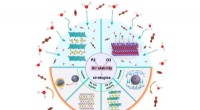 Luftstabilitet af natriumbaserede lagdelte oxidkatodematerialerAdskillige mekanismer og strategier blev vist i denne graf vedrørende luftfølsomheden af lagdelte natriumkatodematerialer. Kredit:Science China Press Natrium-ion-batterier anses for at være et af
Luftstabilitet af natriumbaserede lagdelte oxidkatodematerialerAdskillige mekanismer og strategier blev vist i denne graf vedrørende luftfølsomheden af lagdelte natriumkatodematerialer. Kredit:Science China Press Natrium-ion-batterier anses for at være et af -
 Jernbaserede solceller på vej til at blive mere effektiveKredit:CC0 Public Domain En international undersøgelse ledet fra Lunds Universitet i Sverige viser, at 30 procent af energien i en bestemt type lysabsorberende jernmolekyle forsvinder på en hidtil
Jernbaserede solceller på vej til at blive mere effektiveKredit:CC0 Public Domain En international undersøgelse ledet fra Lunds Universitet i Sverige viser, at 30 procent af energien i en bestemt type lysabsorberende jernmolekyle forsvinder på en hidtil
- Hvad er den molære masse af en gas, der tager tre gange længere tid at effuse end helium?
- Forbrugere stoler mindre på influencers, når der er en række valgmuligheder for et produkt
- Afbalanceret ligning for aluminiumchlorid og cæsium giver?
- Sandt eller falskt er et atom den mindste del af en forbindelse, der stadig kan identificeres som fo…
- Hvad er nettokraften, når et par afbalancerede kræfter fungerer på et objekt?
- Stephen Hawking:en kort genial historie


