Vil niobiumsulfat plus bariumnitrat reagere i en vandig opløsning?
Her er hvorfor:
* opløselighedsregler: Bariumsulfat (BASO4) er generelt uopløselig i vand, mens niobiumnitrat (NB (NO3) 5) er opløselig.
* Dobbeltfortrængningsreaktion: Reaktionen fortsætter som en dobbeltfortrængningsreaktion, hvor kationerne (positive ioner) og anioner (negative ioner) bytterpartnere.
Reaktionsligningen:
NB2 (SO4) 5 (aq) + 5ba (NO3) 2 (aq) → 5baso4 (s) + 2nb (NO3) 5 (aq)
Forklaring:
* reaktanter: Niobiumsulfat (NB2 (SO4) 5) og bariumnitrat (BA (NO3) 2) er begge opløselige i vand og danner ioner.
* Produkter: Bariumsulfat (BASO4) dannes som et hvidt bundfald på grund af dets lave opløselighed. Niobiumnitrat (NB (NO3) 5) forbliver opløst i opløsningen.
Observation:
Reaktionen vil være tydelig ved dannelsen af et hvidt overskyet bundfald (BASO4) i opløsningen.
Sidste artikelDe fleste metalliske malme er produceret af hvilke to typer processer?
Næste artikelHvad er det mest reaktive ikke -metal?
 Varme artikler
Varme artikler
-
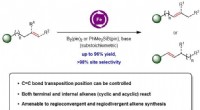 Manipulerer kædevandring i olefiner ved hjælp af jord-rigelige jernbaserede katalysatorerFigur 1:Skematisk viser migration af C =C -bindingen i alkener kan opnås ved hjælp af jernkatalyse med mindre end støkiometriske mængder af en base og borylreagens. Kredit: Journal of the American Che
Manipulerer kædevandring i olefiner ved hjælp af jord-rigelige jernbaserede katalysatorerFigur 1:Skematisk viser migration af C =C -bindingen i alkener kan opnås ved hjælp af jernkatalyse med mindre end støkiometriske mængder af en base og borylreagens. Kredit: Journal of the American Che -
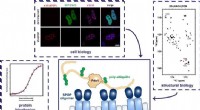 Hvordan ved et reguleringsprotein, hvor det skal bindes for at modulere insulinproduktionen?Penn State -forskere brugte en række forskellige teknikker vedrørende cellebiologi, strukturel biologi, og proteinbiofysik for at bestemme, hvordan proteinerne SPOP og Pdx1 fungerer sammen for at sikr
Hvordan ved et reguleringsprotein, hvor det skal bindes for at modulere insulinproduktionen?Penn State -forskere brugte en række forskellige teknikker vedrørende cellebiologi, strukturel biologi, og proteinbiofysik for at bestemme, hvordan proteinerne SPOP og Pdx1 fungerer sammen for at sikr -
 Nye smarte materialer til at tackle globale udfordringerKredit:Griffith University At forstå, hvordan naturlige materialer skabes, har hjulpet et forskerhold fra Griffith University med at skabe en smart materialeplatform til at hjælpe med at skabe nye
Nye smarte materialer til at tackle globale udfordringerKredit:Griffith University At forstå, hvordan naturlige materialer skabes, har hjulpet et forskerhold fra Griffith University med at skabe en smart materialeplatform til at hjælpe med at skabe nye -
 Forskere rapporterer højtydende solid-state natrium-ion batteriKredit:CC0 Public Domain Solid-state natrium-ion-batterier er langt sikrere end konventionelle lithium-ion-batterier, som udgør en risiko for brand og eksplosioner, men deres ydeevne har været for
Forskere rapporterer højtydende solid-state natrium-ion batteriKredit:CC0 Public Domain Solid-state natrium-ion-batterier er langt sikrere end konventionelle lithium-ion-batterier, som udgør en risiko for brand og eksplosioner, men deres ydeevne har været for
- Paris eksperimenterer med førerløse busser (opdatering)
- Sociale medier kan lære, hvordan man regulerer tale fra onlinespil, viser undersøgelse
- Hvad er 2 måder, hvorpå mennesker hjælper planteproduktion på?
- Er boble dannet i en sodavand et eksempel på eksoterm reaktion?
- Kunne vakuumfysikken afsløres af laserdrevne mikrobobler?
- Hvad er de grundlæggende enheder af længde, volumen, masse og temperatur i det metriske system?


