4NH3 7O2 4NO2 6H2O Hvor mange gram ilt er nødvendige for at producere 4,50 mol NO2?
1. Balance den kemiske ligning
Ligningen, du leverede, er allerede afbalanceret:
4nh₃ + 7o₂ → 4no₂ + 6h₂o
2. Bestem molforholdet
Fra den afbalancerede ligning ser vi, at 7 mol O₂ er påkrævet for at producere 4 mol NO₂.
3. Beregn mol af O₂ nødvendigt
* Brug molforholdet til at finde den nødvendige mol af O₂ nødvendigt:
(4,50 mol No₂) * (7 mol o₂ / 4 mol No₂) =7,875 mol o₂
4. Konverter mol O₂ til gram
* Multiplicer molen af O₂ med den molære masse af O₂ (32,00 g/mol):
(7,875 mol o₂) * (32,00 g/mol) = 252 g o₂
Derfor er 252 gram ilt nødvendigt for at producere 4,50 mol nr.
 Varme artikler
Varme artikler
-
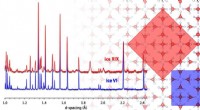 Ny krystallinsk isform:Forskere belyser krystalstruktur for eksotisk is XIXIllustration, der viser forholdet mellem is VI og XIX enhedscellerne set ned ad deres c-akser, og forskellene i deres diffraktionsmønstre, med farvekodning rød for is XIX og blå for is VI. Kredit:Uni
Ny krystallinsk isform:Forskere belyser krystalstruktur for eksotisk is XIXIllustration, der viser forholdet mellem is VI og XIX enhedscellerne set ned ad deres c-akser, og forskellene i deres diffraktionsmønstre, med farvekodning rød for is XIX og blå for is VI. Kredit:Uni -
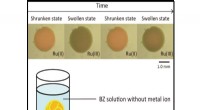 Less is more:En blød, selvbetjent pumpe for at forenkle mekatroniske enhederBelousov-Zhabotinsky hydrogel i opløsning. Kredit:Shibaura Institute of Technology Moderne mekatroniske enheder, fra industrimaskiner til robotter, har set en drastisk stigning i kompleksitet og f
Less is more:En blød, selvbetjent pumpe for at forenkle mekatroniske enhederBelousov-Zhabotinsky hydrogel i opløsning. Kredit:Shibaura Institute of Technology Moderne mekatroniske enheder, fra industrimaskiner til robotter, har set en drastisk stigning i kompleksitet og f -
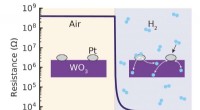 En brintsensor, der fungerer ved stuetemperaturKredit:Delft University of Technology Forskere ved TU Delft har udviklet en meget følsom og alsidig brintsensor, der fungerer ved stuetemperatur. Sensoren er lavet af et tyndt lag af et materiale
En brintsensor, der fungerer ved stuetemperaturKredit:Delft University of Technology Forskere ved TU Delft har udviklet en meget følsom og alsidig brintsensor, der fungerer ved stuetemperatur. Sensoren er lavet af et tyndt lag af et materiale -
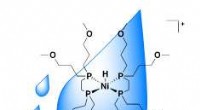 Ny nikkelkatalysator opererer i vand for at omdanne drivhusgas til kemisk råmaterialeNy nikkelkatalysator tilføjer hydrogen (H2) til kuldioxid (CO2) i vand ved hjælp af bikarbonat (NaHCO 3 ) som base. Propylethergrupperne på phosphinliganderne (lange kæder) gør nikkel (Ni)-katalysat
Ny nikkelkatalysator opererer i vand for at omdanne drivhusgas til kemisk råmaterialeNy nikkelkatalysator tilføjer hydrogen (H2) til kuldioxid (CO2) i vand ved hjælp af bikarbonat (NaHCO 3 ) som base. Propylethergrupperne på phosphinliganderne (lange kæder) gør nikkel (Ni)-katalysat
- Pence skitserer US Space Forces plan for næste slagmark
- Hvordan kredser kuldioxid mellem et træ og en ræv?
- Hvordan er cedertræ frø spredt?
- Få to for én:Bonuselektroner i germanium nanokrystaller kan føre til bedre solceller
- Hvad sagde atomteorien?
- Tilstedeværelsen af rige klubber er et spørgsmål om afstand i netværk


