Hvordan dannes et molekyle med brint fra to hydrogeneratomer?
1. Det grundlæggende:
* hydrogenatomer er de enkleste atomer, der hver består af en proton og en elektron.
* Elektroner er negativt ladet og kredser om kernen.
* protoner er positivt ladet og opholder sig i kernen.
2. Bindingsprocessen:
* attraktion: Hydrogenatomer har et enkelt elektron i deres yderste skal. Dette elektron holdes svagt og tiltrækkes af kernen i et andet hydrogenatom.
* deling: De to hydrogenatomer kommer tæt nok til, at deres elektronskyer overlapper hinanden. Dette gør det muligt at dele de to elektroner mellem begge atomer.
* kovalent binding: Det delte par elektroner danner en stærk kovalent binding mellem de to hydrogenatomer. Denne binding holder atomerne sammen og skaber et hydrogenmolekyle (H₂).
3. Stabilitet:
* fuld ydre skal: Ved at dele elektroner har hvert hydrogenatom effektivt en fuld ydre elektronskal, som er en mere stabil tilstand end at have et enkelt elektron. Dette er grunden til, at dannelse af H₂ -molekylet er energisk gunstigt.
visuel repræsentation:
Du kan visualisere dette som to individuelle hydrogenatomer med deres enkelte elektroner hver, sammen og danne et par elektroner, der kredserer begge kerner, der holder atomerne sammen.
Kortfattet: Dannelsen af et hydrogenmolekyle drives af tiltrækningen mellem den positivt ladede kerne for det ene atom og den negativt ladede elektron for den anden. Dette fører til deling af elektroner, danner en stabil kovalent binding og resulterer i et molekyle af brint (H₂).
 Varme artikler
Varme artikler
-
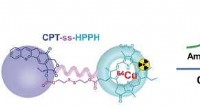 Nanopartikler med multifunktionel lægemiddelprecursor til synergistisk tumorterapiKredit:Wiley Til effektiv kræftbehandling med få bivirkninger, det aktive lægemiddel bør selektivt opnå høj koncentration i tumoren. I journalen Angewandte Chemie , videnskabsmænd har introducer
Nanopartikler med multifunktionel lægemiddelprecursor til synergistisk tumorterapiKredit:Wiley Til effektiv kræftbehandling med få bivirkninger, det aktive lægemiddel bør selektivt opnå høj koncentration i tumoren. I journalen Angewandte Chemie , videnskabsmænd har introducer -
 Portrætter af partiklerKredit:Duke University På solparker på særligt støvede steder i verden, ligesom den arabiske halvø og dele af Indien og Kina, luftforurening koster solenergiindustrien titusinder af milliarder af
Portrætter af partiklerKredit:Duke University På solparker på særligt støvede steder i verden, ligesom den arabiske halvø og dele af Indien og Kina, luftforurening koster solenergiindustrien titusinder af milliarder af -
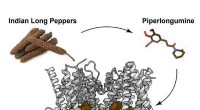 Ingrediens i indisk lang peber viser løfte mod hjernekræft i dyremodellerKredit:Perelman School of Medicine ved University of Pennsylvania Piperlongumine, en kemisk forbindelse fundet i den indiske lange peberplante (Piper longum), er kendt for at dræbe kræftceller i m
Ingrediens i indisk lang peber viser løfte mod hjernekræft i dyremodellerKredit:Perelman School of Medicine ved University of Pennsylvania Piperlongumine, en kemisk forbindelse fundet i den indiske lange peberplante (Piper longum), er kendt for at dræbe kræftceller i m -
 Supercomputing mere lys end varmeMaverick-supercomputersystemet ved Texas Advanced Computing Center. Maverick er en XSEDE-allokeret dedikeret visualiserings- og dataanalyseressource bygget med 132 NVIDIA Tesla K40 Atlas GPU til fjern
Supercomputing mere lys end varmeMaverick-supercomputersystemet ved Texas Advanced Computing Center. Maverick er en XSEDE-allokeret dedikeret visualiserings- og dataanalyseressource bygget med 132 NVIDIA Tesla K40 Atlas GPU til fjern
- Hvilken slags energi bruger et kulforbrændingskraftværk til at skabe dampoperaturbin?
- Tusindvis år gammel egyptisk sarkofag åbnede på direkte tv
- Hvad er oprindelsen af Fokker-Planck-ligningen?
- Hvad er nogle eksempler på at være produktive?
- Hvordan sover pingviner?
- Hvad er mængden af to mængder, hvor forholdet er en kvantitie til anden konstant?


