Når natriumhydroxid tilsættes til vand, hvad sker der?
* opløsning: NaOH opløses i vand og bryder fra hinanden i sine ioner:natriumioner (Na+) og hydroxidioner (OH-).
* varmefrigivelse: Opløsningsprocessen frigiver en betydelig mængde varme, hvilket får løsningen til at føle sig varm. Dette skyldes, at dannelsen af nye bindinger mellem ioner og vandmolekyler frigiver energi.
* Øget pH: Hydroxidionerne (OH-) frigivet af NaOH gør opløsningen meget alkalisk , øger sin pH. PH af en opløsning med NaOH opløst i den vil være større end 7.
* mulige farer: Varmen, der genereres under reaktionen, kan være betydelig. Blanding af NaOH med vand skal udføres omhyggeligt og langsomt, da der kan forekomme sprøjtning, og varmen kan forårsage forbrændinger.
Vigtige noter:
* sikkerhed: Tilføj altid NaOH til vandet, aldrig omvendt. Dette minimerer risikoen for sprøjtning og potentielle forbrændinger.
* Koncentration: Mængden af genereret varme afhænger af koncentrationen af NaOH. Højere koncentrationer producerer mere varme.
* applikationer: Denne reaktion har mange anvendelser, herunder:
* sæbefremstilling: NaOH bruges til at saponificere fedt og olier for at fremstille sæbe.
* Kemisk syntese: NaOH er et almindeligt reagens i mange kemiske reaktioner.
* Industriel rengøring: NaOH bruges til rengøringsprodukter og industrielle processer.
Generelt er tilsætning af natriumhydroxid til vand en kraftig reaktion, der frigiver varme og skaber en meget alkalisk opløsning. Det er vigtigt at håndtere NaOH med forsigtighed på grund af dens ætsende karakter.
Sidste artikelHvad er den generelle formel for alkanoler?
Næste artikelHvilken type binding deler kulstof og svovl?
 Varme artikler
Varme artikler
-
 Hvorfor opbevaret linolie smager bittert, og hvordan man retter detTatjana Lang (v.) og dr. habil. Maik Behrens i deres laboratorium. Kredit:Gisela Olias / LSB Et team af forskere ledet af Leibniz Institut for Fødevaresystembiologi ved det tekniske universitet i M
Hvorfor opbevaret linolie smager bittert, og hvordan man retter detTatjana Lang (v.) og dr. habil. Maik Behrens i deres laboratorium. Kredit:Gisela Olias / LSB Et team af forskere ledet af Leibniz Institut for Fødevaresystembiologi ved det tekniske universitet i M -
 Revner i perovskitfilm til solceller kan let heles, undersøgelse finderEn revnet perovskitfilm (til venstre) kan heles fuldstændigt (højre) med en vis komprimering af lidt varme, ny forskning viser. Resultaterne lover godt for den langsigtede pålidelighed af perovskitfil
Revner i perovskitfilm til solceller kan let heles, undersøgelse finderEn revnet perovskitfilm (til venstre) kan heles fuldstændigt (højre) med en vis komprimering af lidt varme, ny forskning viser. Resultaterne lover godt for den langsigtede pålidelighed af perovskitfil -
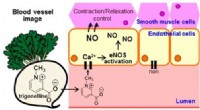 Forbindelser i monsterræddike kunne hjælpe med at tæmme hjerte-kar-sygdommeKredit:American Chemical Society Træd gulerødder til side, løg og broccoli. Den nyeste hjertesunde grøntsag kunne være en gigantisk, rekordsættende radise. I en undersøgelse, der vises i ACS Tids
Forbindelser i monsterræddike kunne hjælpe med at tæmme hjerte-kar-sygdommeKredit:American Chemical Society Træd gulerødder til side, løg og broccoli. Den nyeste hjertesunde grøntsag kunne være en gigantisk, rekordsættende radise. I en undersøgelse, der vises i ACS Tids -
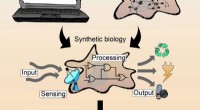 Biologiske signalprocesser i intelligente materialerKredit:Albert-Ludwigs-Universität Freiburg Forskere fra University of Freiburg har udviklet materialesystemer, der er sammensat af biologiske komponenter og polymermaterialer og er i stand til at
Biologiske signalprocesser i intelligente materialerKredit:Albert-Ludwigs-Universität Freiburg Forskere fra University of Freiburg har udviklet materialesystemer, der er sammensat af biologiske komponenter og polymermaterialer og er i stand til at
- Gamle stjernehobe kunne have været fødestedet for supermassive stjerner
- Tror mennesker, at computere træffer rimelige beslutninger?
- Hvordan fungerer en transducer i et HVAC-system?
- Hvis bil 1 har en større inerti end 2 så har?
- Hvad er chlorbutol?
- Undersøgelse illustrerer de kombinerede effekter af klimaændringer og skovbrande


