Hvilket element med det laveste atomnummer indeholder 10 P -elektroner i jordtilstand?
* Forstå elektronkonfiguration: Jordtilstandens elektronkonfiguration beskriver, hvordan elektroner er arrangeret i et atoms orbitaler.
* p-orbitaler: P-orbitaler findes i det andet og højere energiniveau. Hvert energiniveau kan maksimalt have 6 p-elektroner (to i hver af de tre p-orbitaler).
* påfyldningsordre: Elektroner udfylder orbitaler i rækkefølge af stigende energi. Vi bruger Aufbau -princippet og Hunds regel til at bestemme elektronkonfigurationen.
Lad os arbejde igennem det:
1. Start med det laveste energiniveau: Det første energiniveau (n =1) har kun en S-orbital, der kan indeholde maksimalt 2 elektroner.
2. Flyt til det andet energiniveau: Det andet energiniveau (n =2) har både S og P-orbitaler. 2'erne orbital fylder først med 2 elektroner.
3. Fyld p-orbitaler: 2P -orbitaler kan maksimalt indeholde 6 elektroner. Da vi har brug for 10 p-elektroner, skal vi flytte til det næste energiniveau.
4. Tredje energiniveau: 3P -orbitaler kan indeholde 6 elektroner. Vi har allerede fyldt 6 i 2p -orbitaler, så vi har brug for 4 mere.
5. tæller for at finde elementet: For at have i alt 10 p-elektroner, skal atomet have 10 elektroner i alt. Elementet med 10 elektroner er neon (NE) .
Derfor er elementet med det laveste atomnummer, der indeholder 10 p-elektroner i jordtilstanden, neon (NE).
 Varme artikler
Varme artikler
-
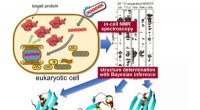 In-situ måling af 3-D proteinstruktur inde i levende eukaryote cellerMålproteiner udtrykkes indeni sf9 celler, derefter målt under anvendelse af in-cell NMR-spektroskopi. Unik statistisk analyse ved hjælp af Bayesiansk slutning anvendes til at beregne den nøjagtige
In-situ måling af 3-D proteinstruktur inde i levende eukaryote cellerMålproteiner udtrykkes indeni sf9 celler, derefter målt under anvendelse af in-cell NMR-spektroskopi. Unik statistisk analyse ved hjælp af Bayesiansk slutning anvendes til at beregne den nøjagtige -
 En ny metode kan gøre tomater mere sikre at spiseKredit:CC0 Public Domain Når grøntsagsbønder høster afgrøder, de er ofte afhængige af vask efter høst for at reducere eventuelle fødevarebårne patogener, men en ny University of Georgia-undersøgel
En ny metode kan gøre tomater mere sikre at spiseKredit:CC0 Public Domain Når grøntsagsbønder høster afgrøder, de er ofte afhængige af vask efter høst for at reducere eventuelle fødevarebårne patogener, men en ny University of Georgia-undersøgel -
 Verdens fineste guldprøve undersøgt med Los Alamos neutronerThe Rams Horn wire guldprøve. Kredit:Harvard University Ved at bruge neutronkarakteriseringsteknikker har et hold videnskabsmænd kigget ind i et af de mest unikke eksempler på trådguld, for første
Verdens fineste guldprøve undersøgt med Los Alamos neutronerThe Rams Horn wire guldprøve. Kredit:Harvard University Ved at bruge neutronkarakteriseringsteknikker har et hold videnskabsmænd kigget ind i et af de mest unikke eksempler på trådguld, for første -
 Immunterapi for dødelige bakterier viser tidligt lovendeVed at stimulere immunsystemet til at ødelægge patogener, Marcos Pires håber at udvikle alternative behandlinger for bakterier, der er resistente over for antibiotika. Kredit:Douglas Benedict/Academic
Immunterapi for dødelige bakterier viser tidligt lovendeVed at stimulere immunsystemet til at ødelægge patogener, Marcos Pires håber at udvikle alternative behandlinger for bakterier, der er resistente over for antibiotika. Kredit:Douglas Benedict/Academic


