Hvorfor er elektronkonfigurationen for kobber 3D10 4S1 - det er 3D9 4S2?
Her er hvorfor:
* stabilitet af en fuld d-orbital: En fuldstændig fyldt D-orbital (D¹⁰) giver ekstra stabilitet. Dette skyldes parring af elektroner, hvilket fører til lavere energiniveau og en mere stabil konfiguration.
* Energiforskel: Mens 4S -orbitalen generelt betragtes som lavere i energi end 3D -orbitalen, kan denne energiforskel være lille. I tilfælde af kobber opvejer den energi, der er opnået ved at fremme en elektron fra 4'erne til 3D -orbitalen, energiforskellen, hvilket fører til en mere stabil 3D¹⁰ -konfiguration.
Tænk på det på denne måde: Det er som at have en fyldt kasse (3D¹⁰) er mere ønskelig end at have en delvist fyldt kasse (3D⁹) og en fuld boks (4S²), selvom den fyldte boks (4S²) er lidt lavere i energi.
Dette fænomen, hvor et enkelt elektron flyttes til et højere energiniveau for at opnå et fyldt eller halvfyldt underskal, er ikke unikt for kobber. Det forekommer også i andre elementer som chrom (CR).
Fortæl mig, hvis du har flere spørgsmål om elektronkonfigurationer!
 Varme artikler
Varme artikler
-
 Driver fremtiden med revolutionerende lithium -ekstraktionsteknikKredit:CC0 Public Domain Et internationalt forskerhold har været banebrydende og patenteret en ny filtreringsteknik, der en dag kan reducere lithium -ekstraktionstider og ændre den måde, fremtiden
Driver fremtiden med revolutionerende lithium -ekstraktionsteknikKredit:CC0 Public Domain Et internationalt forskerhold har været banebrydende og patenteret en ny filtreringsteknik, der en dag kan reducere lithium -ekstraktionstider og ændre den måde, fremtiden -
 Cryo-EM afslører strukturen af protein, der er ansvarlig for at regulere kropstemperaturenCryo-EM billede af TRPM2. Kredit:Wei Lü og Juan Du Et team ledet af Van Andel Research Institute (VARI) forskere har for første gang afsløret strukturen på atomniveau for TRPM2, et protein, der ka
Cryo-EM afslører strukturen af protein, der er ansvarlig for at regulere kropstemperaturenCryo-EM billede af TRPM2. Kredit:Wei Lü og Juan Du Et team ledet af Van Andel Research Institute (VARI) forskere har for første gang afsløret strukturen på atomniveau for TRPM2, et protein, der ka -
 Computermodel afslører effekten af øget kolesterol på specifik ionkanal i hjertetSet ovenfra og ned af den åbne Kir2-kaliumkanal, fremhæver den pore, som ioner bevæger sig igennem. Kredit:Nicolas Barbera Ved hjælp af en computermodel, forskere fra North Carolina State Universi
Computermodel afslører effekten af øget kolesterol på specifik ionkanal i hjertetSet ovenfra og ned af den åbne Kir2-kaliumkanal, fremhæver den pore, som ioner bevæger sig igennem. Kredit:Nicolas Barbera Ved hjælp af en computermodel, forskere fra North Carolina State Universi -
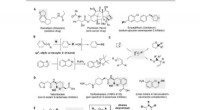 Borindsættelse i alkyletherbindinger via zink/nikkel -tandemkatalyseFunktionalisering af etherbindinger. (A) Småmolekylære lægemidler indeholdende cykliske ethergrupper. Ph, phenyl; Ac, acetyl; Bz, benzoyl; glu, glukose. (B) Overgangsmetal -katalyseret C -O -spaltning
Borindsættelse i alkyletherbindinger via zink/nikkel -tandemkatalyseFunktionalisering af etherbindinger. (A) Småmolekylære lægemidler indeholdende cykliske ethergrupper. Ph, phenyl; Ac, acetyl; Bz, benzoyl; glu, glukose. (B) Overgangsmetal -katalyseret C -O -spaltning


