Hvilken elektronkonfiguration af jod?
1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P⁶ 5S² 4D¹⁰ 5P⁵
Sådan bryder det ned:
* Højeste energiniveau (skaller): Tallene (1, 2, 3, 4, 5) angiver elektronskaller.
* underskaller: Bogstaverne (S, P, D) repræsenterer underskallerne inden for hver skal.
* Elektroner: Superscripts (², ⁶, ¹⁰, ⁵) angiver antallet af elektroner i hvert underskal.
Forklaring:
* Jod har 53 elektroner.
* Konfigurationen følger Aufbau -princippet og påfylder orbitaler i rækkefølge af stigende energi.
* Den sidste elektron kommer ind i 5P -underskalet, der har 5 tilgængelige pletter. Da jod har 53 elektroner, har dens 5P -underskal 5 elektroner.
Lad mig vide, om du vil have en mere visuel forklaring af konfigurationen!
Sidste artikelEr natriumbromidioniske eller kovalente bindinger?
Næste artikelHvilke 2 fossile brændstoffer dannes ved siden af hinanden?
 Varme artikler
Varme artikler
-
 Kemikere bruger rigeligt, billige og giftfri elementer til syntetisering af halvledereJavier Vela og kemikerne i hans forskningsgruppe har arbejdet på at producere halvledere af materialer, der er sikre, rigelig og billig at fremstille. Kredit:Foto af Christopher Gannon og høflighed af
Kemikere bruger rigeligt, billige og giftfri elementer til syntetisering af halvledereJavier Vela og kemikerne i hans forskningsgruppe har arbejdet på at producere halvledere af materialer, der er sikre, rigelig og billig at fremstille. Kredit:Foto af Christopher Gannon og høflighed af -
 Forskere opdager en ny bakteriel resistensmekanisme mod peptidantibiotikaen, BGCerne af bogorol fra B. laterosporus DSM 25 og ATCC 9141, såvel som tridecaptin A og tridecaptin B fra P. polymyxa CICC 10580. BogQ fra stammen DSM 25 og den fra stammen ATCC 9141 deler 85 proce
Forskere opdager en ny bakteriel resistensmekanisme mod peptidantibiotikaen, BGCerne af bogorol fra B. laterosporus DSM 25 og ATCC 9141, såvel som tridecaptin A og tridecaptin B fra P. polymyxa CICC 10580. BogQ fra stammen DSM 25 og den fra stammen ATCC 9141 deler 85 proce -
 Ny aminosyre kan føre til fremskridt på alvorlige sygdommeEn gengivelse af en ny aminosyre (grøn) skabt af Nebraska-kemikere. Forskerne viste, at aminosyren kan inaktivere en type enzym (rødt) forbundet med Parkinsons sygdom, epilepsi og andre helbredsproble
Ny aminosyre kan føre til fremskridt på alvorlige sygdommeEn gengivelse af en ny aminosyre (grøn) skabt af Nebraska-kemikere. Forskerne viste, at aminosyren kan inaktivere en type enzym (rødt) forbundet med Parkinsons sygdom, epilepsi og andre helbredsproble -
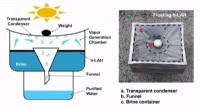 Hydrogelbaseret vandrensningssystem 12 gange bedre end nuværende systemerEt team af forskere fra University of Texas i Austin, samarbejde med en gruppe fra Lockheed Martin Corporation, har udviklet et nyt hydrogelbaseret vandrensningssystem-det er cirka 12 gange bedre end
Hydrogelbaseret vandrensningssystem 12 gange bedre end nuværende systemerEt team af forskere fra University of Texas i Austin, samarbejde med en gruppe fra Lockheed Martin Corporation, har udviklet et nyt hydrogelbaseret vandrensningssystem-det er cirka 12 gange bedre end
- Forskere lærer, hvordan man får ilt til at 'præstere' for dem
- Hvilke energi ændrer sig i et kraftværk?
- Hvor hurtigt bevæger Uranus sig i rummet?
- Hvad er en person, der engagerer sig i den filosofiske undersøgelse af oprindelse og naturunivers?
- 'Råbeafstand':Så tæt ville Inflations Reduction Act bringe USA på deres klimamål
- En studerende har arme af længde 63 cm. Hvad er den minimale vinkelhastighed (i RADS), hvor et span…


