Forskere opdager en ny bakteriel resistensmekanisme mod peptidantibiotika
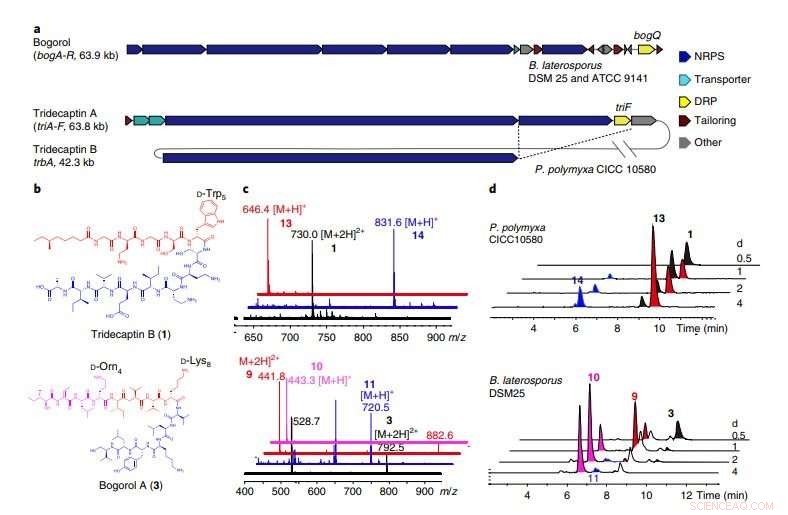
en, BGC'erne af bogorol fra B. laterosporus DSM 25 og ATCC 9141, såvel som tridecaptin A og tridecaptin B fra P. polymyxa CICC 10580. BogQ fra stammen DSM 25 og den fra stammen ATCC 9141 deler 85 procent aminosyresekvensidentitet. De skærende stiplede linjer indikerer gener, der deles af to genklynger i den samme vært (Supplerende Fig. 10). b, Strukturer af DNRP'er tridecaptin B og bogorol A, med DRP-genkendelsesmotiver fremhævet. c, Stablet overlejring af massespektrene (elektrosprayionisering) af moderforbindelser (sort), C-terminale fragmenter (blå), og N-terminale fragmenter (røde). Data er repræsentative for to uafhængige eksperimenter. Top, tridecaptin B; bund, bogorol A. d, Tidsforløbsanalyser af tilsvarende forbindelser produceret af P. polymyxa CICC 10580 (øverst) og B. laterosporus DSM 25 (nederst) ved forskellige fermenteringstider (repræsentativt for tre uafhængige eksperimenter). Kredit:Division of Life Science, HKUST
Ikke-ribosomale peptidantibiotika, inklusive polymyxin, vancomycin, og teixobactin, hvoraf de fleste indeholder D-aminosyrer, er yderst effektive mod multiresistente bakterier. Imidlertid, overforbrug af antibiotika, mens man ignorerer risikoen for opstået resistens, har ubønhørligt ført til udbredt fremkomst af resistente bakterier. At belyse de lidt kendte mekanismer for resistens over for peptidantibiotika er kritisk, når man implementerer peptidantibiotika og ville forbedre effektivt forbedre effektiviteten.
I en nylig undersøgelse, en gruppe videnskabsmænd fra Hong Kong University of Science and Technology afslører både den udbredte distribution og bredspektrede resistenspotentiale af D-stereospecifikke peptidaser, at give en potentiel tidlig indikator for antibiotikaresistens over for ikke-ribosomale peptidantibiotika.
Deres resultater blev offentliggjort i tidsskriftet Naturens kemiske biologi den 26. feb. 2018.
"Vi anvendte en tilgang til 5, 585 komplette bakterielle genomer, der spænder over hele domænet af bakterier, " sagde Pei-Yuan Qian, professor ved afdelingen for biovidenskab, HKUST, og hovedforfatter af papiret. "Med efterfølgende kemiske og enzymatiske analyser, vi demonstrerede en mekanisme for resistens over for ikke-ribosomale peptidantibiotika, der er baseret på hydrolytisk spaltning af D-stereospecifikke peptidaser."
Holdet identificerede en familie af D-stereospecifikke resistenspeptidaser (DRP'er), der er fylogenetisk bredt udbredt i naturen. DRP'erne viste sig at være involveret i bekæmpelsen af vidt udbredte antibiotika indeholdende D-aa for deres værts overlevelse, som blev eksperimentelt valideret af en kombination af CRISPR/Cas9-baseret genredigering, kemiske og enzymatiske analyser.
"I betragtning af DRP'ers potentiale for bredspektret resistens og deres potentiale til at målrette mod klinisk vigtige antibiotika indeholdende D-aa, disse udbredte resistensgener vil sandsynligvis være særligt farlige, hvis de overføres til opportunistiske patogener, " sagde Prof. Qian. "De fund af DRP'er i naturen udgør kun toppen af isbjerget, som vil føre til intens forskning i brug og udvikling af peptidantibiotika til bekæmpelse af antibiotikaresistens."
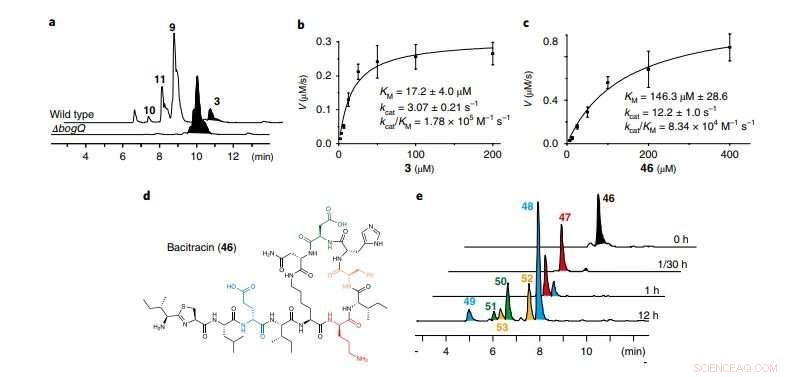
en, LC-MS-spor, der sammenligner vildtype B. laterosporus ATCC 9141 og ΔbogQ-mutanten (repræsentativ for tre uafhængige eksperimenter). b, c, Kinetiske analyser af BogQ-katalyseret hydrolyse af bogorol A (b; 3) og bacitracin (c; 46) v, reaktionshastighed. Data er middel?±?s.d.; n=?3 uafhængige eksperimenter. d, Struktur af DNRP-antibiotikum bacitracin; farver fremhæver spaltningsstederne for BogQ. e, LC-MS spor af in vitro assays af BogQ (2,0 μM) mod 46 (200 μM; repræsentant for to uafhængige eksperimenter). Tidsforløbsspaltningsprodukter (47-53) af 46 er mærket med samme farvekode som deres d-aa-spaltningssteder i d. Til enzymatiske spaltningsmønstre, se Supplerende Fig. 22. Kredit:Division of Life Science, HKUST
 Varme artikler
Varme artikler
-
 Bioaktive naturlige forbindelser til kampen mod kræftSojaplanter producerer glyceolliner som reaktion på patogenangreb såsom svampe, bakterier eller UV-bestråling, for at bevare deres helbred. Kredit:pixabay.com Phytoalexiner er bioaktive fytokemika
Bioaktive naturlige forbindelser til kampen mod kræftSojaplanter producerer glyceolliner som reaktion på patogenangreb såsom svampe, bakterier eller UV-bestråling, for at bevare deres helbred. Kredit:pixabay.com Phytoalexiner er bioaktive fytokemika -
 Omdannelse af CO2 til brugbar energiBrookhaven-forskere er afbilledet ved NSLS-II beamline 8-ID, hvor de brugte ultrastærkt røntgenlys til at se den kemiske kompleksitet af et nyt katalytisk materiale. Fra venstre mod højre ses Klaus At
Omdannelse af CO2 til brugbar energiBrookhaven-forskere er afbilledet ved NSLS-II beamline 8-ID, hvor de brugte ultrastærkt røntgenlys til at se den kemiske kompleksitet af et nyt katalytisk materiale. Fra venstre mod højre ses Klaus At -
 Lab udforsker nye harpikser til lysbaseret 3D-printLLNL -forskere brugte molekylær dynamik (MD) simuleringer til at studere polymerisationen af tre forskellige molekyler fra den samme reaktive gruppe (acrylat), men indeholdende forskellige ikke -rea
Lab udforsker nye harpikser til lysbaseret 3D-printLLNL -forskere brugte molekylær dynamik (MD) simuleringer til at studere polymerisationen af tre forskellige molekyler fra den samme reaktive gruppe (acrylat), men indeholdende forskellige ikke -rea -
 Ny indsigt i modning af miRNA'erForfatterne var i stand til at vise nøjagtigt, hvordan et specifikt RNA-bindende protein (blåt) genkender pri-miR-18a (pink) og ændrer dets struktur på en sådan måde, at det udvikler sig til modent mi
Ny indsigt i modning af miRNA'erForfatterne var i stand til at vise nøjagtigt, hvordan et specifikt RNA-bindende protein (blåt) genkender pri-miR-18a (pink) og ændrer dets struktur på en sådan måde, at det udvikler sig til modent mi


