Hvorfor ilt ikke kan have 1S2 2S2 2P3 3S1-konfiguration i sin jordtilstand, hvilket resulterer i en halvfyldt 2p og 3s orbitaler?
1. Energiniveau: 2P -orbitaler er lavere i energi end 3'erne orbitaler. Elektroner foretrækker naturligvis at besætte de laveste tilgængelige energiniveauer. Fremme af en elektron fra 2p til 3s kræver energiindgang, hvilket gør det til en energisk ugunstig proces i jordtilstanden.
2. Hunds regel: Hunds regel siger, at elektroner individuelt vil besætte orbitaler inden for et underskal, før de fordobles i en orbital. Dette skyldes, at elektroner i separate orbitaler oplever mindre frastødelse, hvilket fører til en lavere energitilstand.
* I den konfiguration, du foreslog, har du et enkelt elektron i 3'erne orbital, mens 2P-underskalet kun er halvfyldt.
* Jordtilstandskonfigurationen, 1S² 2S² 2P⁴, følger Hunds regel ved at udfylde hver af 2p -orbitaler med et enkelt elektron, før de parrer dem op. Dette resulterer i en mere stabil konfiguration.
Kortfattet:
* Jordtilstandskonfigurationen af et atom afspejler den lavest mulige energitilstand.
* 2P -orbitaler er lavere i energi end 3'erne orbitaler.
* Hunds regel favoriserer halvfyldte og fuldt fyldte underskaller for større stabilitet.
Selvom konfigurationen 1S² 2s² 2p³ 3S¹ kan virke tiltalende, er det ikke det mest stabile eller energisk gunstige arrangement for ilt i dens jordtilstand.
Sidste artikelHvad er produktet af selvionisering SO2?
Næste artikelHvorfor er forbindelser vigtige for livet på jorden?
 Varme artikler
Varme artikler
-
 Forskere opdager naturligt plantebaseret fødevarekonserveringsmiddelForskere ved NTU Singapore har opdaget et plantebaseret fødevarekonserveringsmiddel, der er mere effektivt end kunstige konserveringsmidler. Kredit:NTU Singapore Nanyang Teknologisk Universitet, S
Forskere opdager naturligt plantebaseret fødevarekonserveringsmiddelForskere ved NTU Singapore har opdaget et plantebaseret fødevarekonserveringsmiddel, der er mere effektivt end kunstige konserveringsmidler. Kredit:NTU Singapore Nanyang Teknologisk Universitet, S -
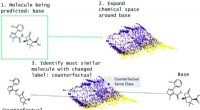 Brug af kontrafakta til at verificere forudsigelser om lægemiddelsikkerhedOversigt over MMACE. Inputtet er et molekyle, der skal forudsiges. Kemisk rum udvides og klynges. Kontrafakta er udvalgt fra klynger for at finde en kortfattet forklaring på forudsigelse af basemoleky
Brug af kontrafakta til at verificere forudsigelser om lægemiddelsikkerhedOversigt over MMACE. Inputtet er et molekyle, der skal forudsiges. Kemisk rum udvides og klynges. Kontrafakta er udvalgt fra klynger for at finde en kortfattet forklaring på forudsigelse af basemoleky -
 Biosensor til tungmetallerRamon Weishaupt under en række tests med blodserum. Kredit:Swiss Federal Laboratories for Materials Science and Technology Et team af Empa -forskere har udviklet en biosensor, der giver dem muligh
Biosensor til tungmetallerRamon Weishaupt under en række tests med blodserum. Kredit:Swiss Federal Laboratories for Materials Science and Technology Et team af Empa -forskere har udviklet en biosensor, der giver dem muligh -
 Skadebesparende sommertidAnalytiske resultater og metode for organisk solcelle efter 100 timers lysbestråling Kredit:Kanazawa University Forskere ved Kanazawa University har udført en detaljeret undersøgelse af de molekyl
Skadebesparende sommertidAnalytiske resultater og metode for organisk solcelle efter 100 timers lysbestråling Kredit:Kanazawa University Forskere ved Kanazawa University har udført en detaljeret undersøgelse af de molekyl
- Hvordan patogener kan slå mitokondrielle forsvarsmekanismer fra
- Hvilken kraft får objekterne i rummet til at blive holdt sammen?
- Står solen op fra tidspunktet for solopgang til middag?
- Hvad hedder den lyseste stjerne på Big Dipper?
- Hvilken jord dannes ved udvaskning og oxidation?
- Hvordan beregnes procent udbytte?


