Hvad er egenskaberne ved nitrogen?
egenskaber ved nitrogen:
Fysiske egenskaber:
* farveløs, lugtfri og smagløs gas: Kvælstof er usynlig og har ingen tydelig lugt eller smag.
* diatomisk molekyle: Kvælstof findes som et diatomisk molekyle (N₂).
* ikke-brandfarlig: Nitrogen i sig selv brænder ikke.
* Lav reaktivitet: Nitrogen er relativt ureaktiv under standardbetingelser.
* flydende ved -195,8 ° C (-320,4 ° F) og størkner ved -210 ° C (-346 ° F): Kvælstof kan omdannes til væske og faste tilstande ved meget lave temperaturer.
* densitet: Kvælstofgas er lidt lettere end luft.
* opløselighed i vand: Kvælstof er dårligt opløseligt i vand.
Kemiske egenskaber:
* inert under normale forhold: Nitrogen er relativt ureaktiv på grund af dets stærke tredobbelte binding.
* danner oxider: Nitrogen kan reagere med ilt under høje temperaturer for at danne oxider som nitrogenmonoxid (NO) og nitrogendioxid (NO₂).
* Formularer ammoniak: Nitrogen reagerer med brint til dannelse af ammoniak (NH₃).
* danner nitrater: Kvælstof kan fastgøres i nitrater (NO₃⁻) af visse bakterier, hvilket gør det tilgængeligt for planter.
* essentiel for livet: Nitrogen er en nøglekomponent i proteiner, nukleinsyrer (DNA og RNA) og andre essentielle biomolekyler.
Andre bemærkelsesværdige egenskaber:
* rigelig i atmosfæren: Kvælstof udgør omkring 78% af Jordens atmosfære.
* Brugt i forskellige industrielle applikationer: Kvælstof bruges i forskellige industrier, herunder fødevarebeskyttelse, svejsning og elektronikproduktion.
* Brugt i medicin: Kvælstof bruges i medicinske anvendelser som kryokirurgi.
Bemærk: Egenskaberne ved nitrogen kan variere afhængigt af dets fysiske tilstand og kemiske miljø.
Sidste artikelHvad er bi-natriumcarbonat?
Næste artikelHvad er oxidationstilstand af ilt i HOF?
 Varme artikler
Varme artikler
-
 Vurdering af den luftbårne overlevelse af bakterier i aerosoldråber fra hoste og nysVed at bruge den nye tilgang, skyer af aerosoldråber (f.eks. 40 vist på billedet) kan fanges og manipuleres, muliggør en simulering af deres miljøeksponering Kredit:University of Bristol Den luftb
Vurdering af den luftbårne overlevelse af bakterier i aerosoldråber fra hoste og nysVed at bruge den nye tilgang, skyer af aerosoldråber (f.eks. 40 vist på billedet) kan fanges og manipuleres, muliggør en simulering af deres miljøeksponering Kredit:University of Bristol Den luftb -
 Guldbindingsdannelse spores i realtid ved hjælp af ny molekylær spektroskopi-teknikFigur 1:Et formskiftende molekyle snapper fra en bøjet (øverst til højre) til en lige struktur (nederst til højre), når det rammes af en ultraviolet laserimpuls (lilla krumspring øverst i midten). To
Guldbindingsdannelse spores i realtid ved hjælp af ny molekylær spektroskopi-teknikFigur 1:Et formskiftende molekyle snapper fra en bøjet (øverst til højre) til en lige struktur (nederst til højre), når det rammes af en ultraviolet laserimpuls (lilla krumspring øverst i midten). To -
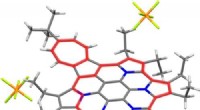 Dobbelt aromatiske ringe stabiliserer multikationerPyrrol- og azulenfusioneret azacoronen-dikering med 22π 6π aromatiske ringe. Kredit:American Chemical Society Et redoxaktivt polycyklisk aromatisk kulbrinte (PAHer) sammensat af azulen og pyrroler
Dobbelt aromatiske ringe stabiliserer multikationerPyrrol- og azulenfusioneret azacoronen-dikering med 22π 6π aromatiske ringe. Kredit:American Chemical Society Et redoxaktivt polycyklisk aromatisk kulbrinte (PAHer) sammensat af azulen og pyrroler -
 Ny katalysator imødekommer udfordringen med at rense udstødningen fra moderne motorerForskere ved WSU, PNNL og University of New Mexico har udviklet en bedre katalysator til katalysatorer, der ændrer køretøjsforurenende stoffer til relativt godartede former for nitrogen, kuldioxid og
Ny katalysator imødekommer udfordringen med at rense udstødningen fra moderne motorerForskere ved WSU, PNNL og University of New Mexico har udviklet en bedre katalysator til katalysatorer, der ændrer køretøjsforurenende stoffer til relativt godartede former for nitrogen, kuldioxid og
- Hvor mange liter C2H2 skal produceres fra 80 gram H2O?
- Forskere observerer eksperimentelt strømdrevet antiskyrmion-glidning
- Mikroskopiske folder, der strækker sig fra den apikale overflade af visse epithelia for at øge omr…
- Hvad er de stjerner, vi ser i vores solsystem?
- Sådan laver du en brænderbrænder
- Forskere ser en planetarisk tåge indefra og ud


