Hvad er oxidationstilstand af ilt i HOF?
Forståelse af oxidationstilstande
* Oxidationstilstand er et tal, der er tildelt et atom i et molekyle eller ion, der repræsenterer dets hypotetiske ladning, hvis alle bindinger var 100% ioniske.
* regler:
* Oxidationstilstanden for et frit element er altid 0.
* Summen af oxidationstilstande i et neutralt molekyle er 0.
* Summen af oxidationstilstande i en polyatomisk ion er lig med ladningen af ion.
* Fluor (F) har en oxidationstilstand på -1 i sine forbindelser (undtagen i F₂).
* Hydrogen (H) har en oxidationstilstand på +1 i sine forbindelser (undtagen i metalhydrider, hvor det er -1).
anvender reglerne på HOF
1. fluorens oxidationstilstand: Fluor har altid en oxidationstilstand på -1, så F er -1 i HOF.
2. Hydrogen's oxidationstilstand: Hydrogen er bundet til et mere elektronegativt element (ilt), så dens oxidationstilstand er +1.
3. Oxygen's oxidationstilstand (lad os kalde det "X"): Da den samlede afgift for HOF er 0, kan vi indstille ligningen:
(+1) + (x) + (-1) =0
4. Løsning til x:
x =0
Derfor er oxidationstilstanden ilt i HOF 0.
Sidste artikelHvad er egenskaberne ved nitrogen?
Næste artikelVille nitrogen og fosfor danne en kovalent binding?
 Varme artikler
Varme artikler
-
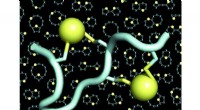 Dobbeltbroede peptider binder ethvert sygdomsmålEn model af et dobbeltbrokoblet peptid (peptidet i lyseblåt, de to broer i gult). Baggrunden for figurerne viser mange eksempler på skeletter (også kaldet stilladser eller rygrade) af dobbeltbroforbun
Dobbeltbroede peptider binder ethvert sygdomsmålEn model af et dobbeltbrokoblet peptid (peptidet i lyseblåt, de to broer i gult). Baggrunden for figurerne viser mange eksempler på skeletter (også kaldet stilladser eller rygrade) af dobbeltbroforbun -
 Frigør potentialet for metalnanopartikler som katalysatorer for hurtig og effektiv CO2-omdannelseNano-arkitektur:nikkelpartikler præcis 1/40, 000. på størrelse med et menneskehår er de bedste katalysatorer til omdannelse af CO2. Kredit:Utrecht University / Uorganisk kemi og katalyse O 2 og
Frigør potentialet for metalnanopartikler som katalysatorer for hurtig og effektiv CO2-omdannelseNano-arkitektur:nikkelpartikler præcis 1/40, 000. på størrelse med et menneskehår er de bedste katalysatorer til omdannelse af CO2. Kredit:Utrecht University / Uorganisk kemi og katalyse O 2 og -
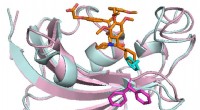 Depression, fedme, kroniske smerter kan behandles ved at målrette det samme nøgleproteinEn ny inhibitor (orange) er selektiv for FKBP51, som er involveret i depression, kroniske smerter og fedme. Kredit:Felix Hausch Større depression, fedme og kronisk smerte er alle forbundet med vir
Depression, fedme, kroniske smerter kan behandles ved at målrette det samme nøgleproteinEn ny inhibitor (orange) er selektiv for FKBP51, som er involveret i depression, kroniske smerter og fedme. Kredit:Felix Hausch Større depression, fedme og kronisk smerte er alle forbundet med vir -
 At afsløre træets nanostruktur kan hjælpe med at hæve højdegrænserne for træskyskrabereKredit:CC0 Public Domain Der er stigende interesse rundt om i verden for at bruge træ som lighter, mere bæredygtigt byggealternativ til stål og beton. Mens træ har været brugt i bygninger i årtusi
At afsløre træets nanostruktur kan hjælpe med at hæve højdegrænserne for træskyskrabereKredit:CC0 Public Domain Der er stigende interesse rundt om i verden for at bruge træ som lighter, mere bæredygtigt byggealternativ til stål og beton. Mens træ har været brugt i bygninger i årtusi


