Hvad er den langhandlede elektronkonfiguration til svovl?
1S² 2S² 2P⁶ 3S² 3P⁴
Sådan ankommer vi til dette:
* svovl (r) Har et atomnummer på 16, hvilket betyder, at det har 16 protoner og 16 elektroner.
* 1S²: Det første energiniveau (n =1) har en underskal (er), der kan holde op til 2 elektroner.
* 2s²: Det andet energiniveau (n =2) har ens underskal, der kan holde op til 2 elektroner.
* 2p⁶: Det andet energiniveau har også et P -underskal, der kan holde op til 6 elektroner.
* 3S²: Det tredje energiniveau (n =3) har ens underskal, der kan holde op til 2 elektroner.
* 3p⁴: Det tredje energiniveau har også et P -underskal, der kan holde op til 6 elektroner. I tilfælde af svovl har det kun 4 elektroner i dette underskal.
Fortæl mig, hvis du gerne vil have den kortfyldte elektronkonfiguration eller have andre spørgsmål!
Sidste artikelHvad bruger du guldchlorid til?
Næste artikelHvordan tegner du elektronkonfigurationen til ilt?
 Varme artikler
Varme artikler
-
 Rheostat identificeret, der hjælper med at regulere celledød versus overlevelsesbeslutningerForfattere Richard Kriwacki, PhD, og Aaron Phillips, PhD, identificeret, hvordan en ustruktureret eller iboende forstyrret region (IDR) i Bcl-xL giver større fleksibilitet til overvågning af forhold o
Rheostat identificeret, der hjælper med at regulere celledød versus overlevelsesbeslutningerForfattere Richard Kriwacki, PhD, og Aaron Phillips, PhD, identificeret, hvordan en ustruktureret eller iboende forstyrret region (IDR) i Bcl-xL giver større fleksibilitet til overvågning af forhold o -
 Multifunktionelle porøse ledende membraner hjælper mikrober med at spise sig frem til en hurtigere…Illustration af den mikrobielle elektrosynteseproces, hvorved levende mikrober omdanner kuldioxid til nyttige kemikalier i en elektrokemisk celle via en reduktionsreaktion under påført spænding. Kredi
Multifunktionelle porøse ledende membraner hjælper mikrober med at spise sig frem til en hurtigere…Illustration af den mikrobielle elektrosynteseproces, hvorved levende mikrober omdanner kuldioxid til nyttige kemikalier i en elektrokemisk celle via en reduktionsreaktion under påført spænding. Kredi -
 At skabe attraktion mellem molekyler dybt i det periodiske systemKredit:CC0 Public Domain Et McGill-ledet internationalt forskerhold giver det første eksperimentelle og teoretiske bevis på, at det er muligt at danne stærke, stabile attraktioner mellem nogle af
At skabe attraktion mellem molekyler dybt i det periodiske systemKredit:CC0 Public Domain Et McGill-ledet internationalt forskerhold giver det første eksperimentelle og teoretiske bevis på, at det er muligt at danne stærke, stabile attraktioner mellem nogle af -
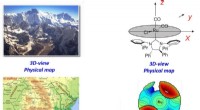 Kortlægning af den tredimensionelle struktur af katalytiske centre hjælper med at designe nye og f…3D -strukturen af landskabsbilledet (øverst til venstre) kan sammenlignes med 3D -billedet af katalysatoren (øverst til højre). Tilsvarende det geografiske kort (nederst til venstre) kan sammenligne
Kortlægning af den tredimensionelle struktur af katalytiske centre hjælper med at designe nye og f…3D -strukturen af landskabsbilledet (øverst til venstre) kan sammenlignes med 3D -billedet af katalysatoren (øverst til højre). Tilsvarende det geografiske kort (nederst til venstre) kan sammenligne
- Klimaændringer truer op til 100 % af træerne i australske byer og de fleste byarter på verdenspla…
- Californiens tørre områder er hotspots for plantediversitet
- Hvordan reproducerer vandmeloner?
- Tæller de forskellige grene åh fysik?
- Hvad er de tre almindelige varmekilder til pumper?
- Syntetisering af nye supertunge grundstoffer for at åbne den ottende periode i det periodiske syste…


