Hvordan tegner du elektronkonfigurationen til ilt?
1. Bestem Oxygen's atomnummer:
* Oxygen har et atomnummer på 8, hvilket betyder, at det har 8 protoner og 8 elektroner.
2. Fyld energiniveauet:
* Første energiniveau (n =1): Holder maksimalt 2 elektroner.
* Vi repræsenterer dette med symbolet "1S²", hvilket betyder 2 elektroner i 's' underskalet for det første energiniveau.
* andet energiniveau (n =2): Holder maksimalt 8 elektroner, opdelt i to underskaller:
* 'S' Subshell:Holder maksimalt 2 elektroner. Vi repræsenterer dette med "2S²".
* 'P' underskal:holder maksimalt 6 elektroner. Vi repræsenterer dette med "2p⁴".
3. Komplet elektronkonfiguration:
* Den fulde elektronkonfiguration for ilt er: 1S² 2S² 2P⁴
visuel repræsentation:
Du kan også repræsentere dette visuelt ved hjælp af orbitaldiagrammer:
* 1s orbital: Tegn en cirkel og læg to pile, der peger i modsatte retninger (↑ ↓) for at repræsentere de to elektroner med modsatte spins.
* 2s orbital: Tegn en anden cirkel med to pile, der peger i modsatte retninger (↑ ↓).
* 2p orbitaler: Tegn tre cirkler (PX, PY, PZ), der repræsenterer de tre P -orbitaler. Hver orbital kan holde op til 2 elektroner. Da ilt har 4 elektroner i P -underskalet, skal du placere to pile (↑ ↓) i en P -orbital og en pil (↑) i hver af de to andre orbitaler.
Vigtig note: Husk, at elektronerne i P -orbitaler vil udfylde individuelt, før de fordobles i en hvilken som helst orbital (Hunds regel).
Lad mig vide, om du vil have en visuel repræsentation af dette ved hjælp af orbitaldiagrammer!
 Varme artikler
Varme artikler
-
 En mere kortfattet måde at syntetisere tetrodotoxin påKredit:Unsplash/CC0 Public Domain Et lille internationalt team af forskere har udviklet en måde at syntetisere tetrodotoxin (TTX) ved at bruge langt færre trin end tidligere metoder. I deres papir
En mere kortfattet måde at syntetisere tetrodotoxin påKredit:Unsplash/CC0 Public Domain Et lille internationalt team af forskere har udviklet en måde at syntetisere tetrodotoxin (TTX) ved at bruge langt færre trin end tidligere metoder. I deres papir -
 Ny nanopladebelægning kunne erstatte ikke-genanvendelige metalliserede film i fødevareemballageLDH nanoark med højt billedformat. en Skematisk, der viser (I) kalcinering (mellemlagsvand og anioner fjernes ved kalcinering) og (II) rekonstruktionsproces og den foretrukne væksthæmning i en opløsni
Ny nanopladebelægning kunne erstatte ikke-genanvendelige metalliserede film i fødevareemballageLDH nanoark med højt billedformat. en Skematisk, der viser (I) kalcinering (mellemlagsvand og anioner fjernes ved kalcinering) og (II) rekonstruktionsproces og den foretrukne væksthæmning i en opløsni -
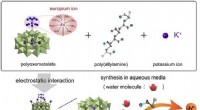 Hybridmateriale flytter næste generations transportbrændstofceller tættere påUltrahøj protonkonduktion i polyoxometalatbaseret ramme Billedtekst:Ultrahøj protonkonduktion via udvidet hydrogenbindingsnetværk i polyoxometalatbaseret ramme, der er funktionaliseret med Lanthanide
Hybridmateriale flytter næste generations transportbrændstofceller tættere påUltrahøj protonkonduktion i polyoxometalatbaseret ramme Billedtekst:Ultrahøj protonkonduktion via udvidet hydrogenbindingsnetværk i polyoxometalatbaseret ramme, der er funktionaliseret med Lanthanide -
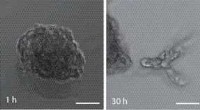 Dyrkning af mikrovæv til erstatning for dyreforsøgVed at bruge princippet om litografi, en infrarød laser skriver præcise strukturer ind i matricen. Cellerne vokser efter den specificerede plan. Dette åbner nye muligheder for generering af tredimensi
Dyrkning af mikrovæv til erstatning for dyreforsøgVed at bruge princippet om litografi, en infrarød laser skriver præcise strukturer ind i matricen. Cellerne vokser efter den specificerede plan. Dette åbner nye muligheder for generering af tredimensi
- Dette materiale findes kun i den kontinentale skorpe?
- Undersøgelse undersøger, hvornår og hvorfor bestikkelse køber indflydelse, hvad der mindsker der…
- Midt i grænsemurdebatten, smart teknologi rejser også spørgsmål
- Det område af en lang knogle, hvor væksten i længden sker, er?
- Hvad er farve på bromidioner?
- Sådan beregnes fordampningshastigheder


