Hvad er den molekylære formel for forbindelse, der indeholder 30,4 procent nitrogen og 69,6 ilt ved masse, der har en molar på 92,0 g?
1. Bestem den empiriske formel:
* Antag en 100 g prøve: Dette gør beregningerne lettere. I en 100 g prøve har du 30,4 g nitrogen (N) og 69,6 g ilt (O).
* Konverter masse til mol:
* Mol n =30,4 g / 14,01 g / mol (molmasse på n) ≈ 2,17 mol
* Mol O =69,6 g / 16,00 g / mol (molmasse O) ≈ 4,35 mol
* Find det enkleste forhold mellem hele nummer: Del begge molværdier med den mindre (2,17 mol):
* N:2.17 / 2.17 =1
* O:4.35 / 2.17 ≈ 2
* Den empiriske formel er ingen₂.
2. Bestem den molekylære formel:
* Beregn den empiriske formelmasse: NO₂ har en masse på 14,01 g/mol + (2 x 16,00 g/mol) =46,01 g/mol.
* Find forholdet mellem den molære masse og den empiriske formelmasse: 92,0 g/mol/46,01 g/mol ≈ 2
* Multiplicer underskrifterne i den empiriske formel med dette forhold: Ingen₂ * 2 = n₂o₄
Derfor er den molekylære formel for forbindelsen n₂o₄.
Sidste artikelHvad er en unik egenskab for svovl?
Næste artikelHvad er den afbalancerede ligning, når jod reagerer med natriumhydroxid?
 Varme artikler
Varme artikler
-
 Stort dipolmoment induceret bredspektret bismuthchromat for effektiv fotokatalytisk ydeevne(a) sammenligning af fotokatalytisk vandoxidationsaktivitet med forskellige fotokatalysatorer og (b) den bølgelængdeafhængige AQE af vandoxidation over Bi 8 (CrO 4 ) O 11 . (c) sammenligning af
Stort dipolmoment induceret bredspektret bismuthchromat for effektiv fotokatalytisk ydeevne(a) sammenligning af fotokatalytisk vandoxidationsaktivitet med forskellige fotokatalysatorer og (b) den bølgelængdeafhængige AQE af vandoxidation over Bi 8 (CrO 4 ) O 11 . (c) sammenligning af -
 Søger de mest effektive polymerer til personligt beskyttelsesudstyrBrug fluorescens til at demonstrere, hvordan partikler binder forskelligt til forskellige materialetyper. Kredit:Morgan Alexander Personligt beskyttelsesudstyr, som ansigtsmasker og kjoler, er gen
Søger de mest effektive polymerer til personligt beskyttelsesudstyrBrug fluorescens til at demonstrere, hvordan partikler binder forskelligt til forskellige materialetyper. Kredit:Morgan Alexander Personligt beskyttelsesudstyr, som ansigtsmasker og kjoler, er gen -
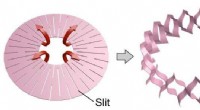 Elektronik integreret i musklen via Kirigami2D -doughnutform (venstre:før deformation) og 3D -cylindrisk form (højre:efter deformation). Kredit:Toyohashi University of Technology. Et forskerhold i afdelingen for elektrisk og elektronisk inf
Elektronik integreret i musklen via Kirigami2D -doughnutform (venstre:før deformation) og 3D -cylindrisk form (højre:efter deformation). Kredit:Toyohashi University of Technology. Et forskerhold i afdelingen for elektrisk og elektronisk inf -
 Grøn te-molekyle kunne forhindre hjerteanfaldKredit:CC0 Public Domain Grøn te kan være nøglen til at forhindre dødsfald fra hjerteanfald og slagtilfælde forårsaget af åreforkalkning, ifølge forskning finansieret af British Heart Foundation o
Grøn te-molekyle kunne forhindre hjerteanfaldKredit:CC0 Public Domain Grøn te kan være nøglen til at forhindre dødsfald fra hjerteanfald og slagtilfælde forårsaget af åreforkalkning, ifølge forskning finansieret af British Heart Foundation o


