Hvor mange elektroner ville et neutralt atom af nitrogen have brug for at tabe for at have fuld valenselektronskal?
* nitrogens elektronkonfiguration: Nitrogen har et atomnummer på 7, hvilket betyder, at det har 7 protoner og 7 elektroner. Dens elektronkonfiguration er 1S² 2s² 2p³.
* Valenselektroner: Valenselektronerne er dem i den yderste skal, som i nitrogens tilfælde er i 2'erne og 2p orbitaler. Der er 5 valenselektroner (2S² 2p³).
* Fuld valence Shell: En fuld valensskal til nitrogen ville have 8 elektroner (2S² 2P⁶).
* elektroner til at tabe: For at opnå en fuld valensskal skulle nitrogenet få 3 elektroner (mister ikke nogen).
Vigtig note: Atomer får eller mister elektroner for at opnå en stabil, fuld ydre skalkonfiguration. Det er mere sandsynligt, at nitrogen får elektroner til at blive en anion (negativt ladet ion) med en -3 -ladning.
Sidste artikelHvorfor er kulstof rygraden i organiske forbindelser?
Næste artikelHvad er kemisk cykling?
 Varme artikler
Varme artikler
-
 Syntetisk kanal med en stærk præference for kaliumioner tilbyder hurtig transport gennem kunstig m…Dette scanningselektronmikroskopbillede viser, at de kunstige ionkanaler selv samler sig til fibre. Kredit:American Chemical Society Kunstige ionkanaler udviklet af A*STAR-forskere kan bane vejen
Syntetisk kanal med en stærk præference for kaliumioner tilbyder hurtig transport gennem kunstig m…Dette scanningselektronmikroskopbillede viser, at de kunstige ionkanaler selv samler sig til fibre. Kredit:American Chemical Society Kunstige ionkanaler udviklet af A*STAR-forskere kan bane vejen -
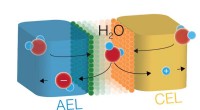 Forskere adskiller vand effektivt med nye katalysatorerForskning i et kemilaboratorium fra University of Oregon har fremskyndet effektiviteten af den katalytiske vanddissociationsreaktion i bipolære membraner. Et team på tre medlemmer brugte en membran-
Forskere adskiller vand effektivt med nye katalysatorerForskning i et kemilaboratorium fra University of Oregon har fremskyndet effektiviteten af den katalytiske vanddissociationsreaktion i bipolære membraner. Et team på tre medlemmer brugte en membran- -
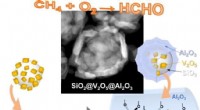 Forskere finder nye måder at udnytte spildt metan påSkematisk billede, der viser SiO 2 @V 2 O 5 @Al 2 O 3 core@shell nanostrukturer. Kredit:UNIST Den primære komponent i naturgas, metan, er i sig selv en potent drivhusgas. En nylig unders
Forskere finder nye måder at udnytte spildt metan påSkematisk billede, der viser SiO 2 @V 2 O 5 @Al 2 O 3 core@shell nanostrukturer. Kredit:UNIST Den primære komponent i naturgas, metan, er i sig selv en potent drivhusgas. En nylig unders -
 At omdanne vand til brint mere effektivtKredit:Leiden Universitet Forskere har længe været forundret over, hvorfor det er lettere at producere brint fra vand i et surt miljø end i et alkalisk miljø. Marc Koper kommer med en forklaring:Å
At omdanne vand til brint mere effektivtKredit:Leiden Universitet Forskere har længe været forundret over, hvorfor det er lettere at producere brint fra vand i et surt miljø end i et alkalisk miljø. Marc Koper kommer med en forklaring:Å
- Hvorfor kan flytte vand bruges til at producere elektricitet?
- Er der behov for energi til at fotosnerese finder sted?
- Hvad er vinkelaccelerationen på minuthånden et ur?
- Hvordan måler folk højden af et topmøde?
- Hvad er et eksempel på bevarelse af momentum?
- Tvetydighedens magt:Brug af computermodeller til at forstå debatten om klimaændringer


