Hvilken effekt doe aluminiumssulfat har på PH af vand?
Her er hvorfor:
* Hydrolyse: Når aluminiumssulfat opløses i vand, gennemgår det hydrolyse, en reaktion, hvor vandmolekyler nedbryder saltet. Denne proces producerer aluminiumioner (al³⁺) og sulfationer (so₄²⁻).
* aluminiumioner: Aluminiumioner reagerer med vand for at danne hydratiserede aluminiumioner ([AL (H₂O) ₆] ³⁺) og brintioner (H⁺):
* Al³⁺ + 6h₂o ⇌ [al (H₂O) ₆] ³⁺
* [Al (H₂O) ₆] ³⁺ ⇌ [al (H₂O) ₅ (OH)] ²⁺ + H⁺
* Øget surhedsgrad: Frigivelsen af hydrogenioner (H⁺) øger koncentrationen af hydrogenioner i vandet, hvilket resulterer i en lavere pH -værdi.
Praktiske applikationer:
Denne egenskab ved aluminiumssulfat bruges i forskellige applikationer, herunder:
* Vandbehandling: Alun er en almindelig koagulant i vandbehandling. Det hjælper med at fjerne suspenderede partikler ved at danne flokke (små klumper), der sætter sig ud, klarer vandet. Den sure karakter af aluminiumssulfat kan også hjælpe med at kontrollere vandets pH.
* Jordændring: Aluminiumsulfat kan bruges til at syre jord, hvilket er gavnligt for planter, der foretrækker sure forhold.
Vigtig note:
I hvilket omfang aluminiumssulfat påvirker pH afhænger af flere faktorer, herunder:
* Koncentration: Højere koncentrationer af aluminiumssulfat vil føre til et større fald i pH.
* indledende pH: Den indledende pH i vandet vil også påvirke den endelige pH efter tilsætning af aluminiumssulfat.
* Temperatur: Temperaturen kan påvirke hastigheden for hydrolyse.
Konsulter altid med fagfolk eller følg sikkerhedsretningslinjerne, når du bruger aluminiumssulfat.
Sidste artikelUdover nitrogen og ilt Hvilken anden gas er en del af vores luft?
Næste artikelHvad er 5 jernholdige metaller?
 Varme artikler
Varme artikler
-
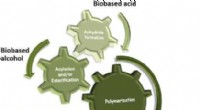 Økonomisk syntese af polyacrylater og polymethacrylater fra biobaserede materialerKredit:Angewandte Chemie På trods af industriens bedste indsats for at arbejde hen imod bæredygtighed, de fleste plastik (eller polymerer) er stadig fremstillet ved hjælp af ikke-fornybare fossile
Økonomisk syntese af polyacrylater og polymethacrylater fra biobaserede materialerKredit:Angewandte Chemie På trods af industriens bedste indsats for at arbejde hen imod bæredygtighed, de fleste plastik (eller polymerer) er stadig fremstillet ved hjælp af ikke-fornybare fossile -
 Strækbare superkondensatorer til at drive morgendagens bærbare enhederDisse skovlignende rækker af kulstofnanorør blev skabt på et elastomersubstrat, der blev forstrakt i én retning og derefter fik lov til at trække sig sammen. Denne proces skaber strækbare superkondens
Strækbare superkondensatorer til at drive morgendagens bærbare enhederDisse skovlignende rækker af kulstofnanorør blev skabt på et elastomersubstrat, der blev forstrakt i én retning og derefter fik lov til at trække sig sammen. Denne proces skaber strækbare superkondens -
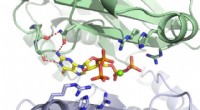 Metode til at undersøge, hvordan bakterier reagerer på sult, probe cellevækstEt MIT-hold har opdaget, at det lille molekyle ppGpp (rødt) binder til PurF-enzymet (underenheder vist i grønt og lilla). Kredit:Massachusetts Institute of Technology I 1969, videnskabsmand Michae
Metode til at undersøge, hvordan bakterier reagerer på sult, probe cellevækstEt MIT-hold har opdaget, at det lille molekyle ppGpp (rødt) binder til PurF-enzymet (underenheder vist i grønt og lilla). Kredit:Massachusetts Institute of Technology I 1969, videnskabsmand Michae -
 Forskere udvikler syntetiske stilladser til at helbrede skadede sener og ledbåndForskningen håber at forbedre resultaterne af sportsskadeoperationer. Kredit:Pixabay Australiens kærlighed til sport betyder, at det har en af de højeste forekomster af forreste korsbånd (ACL) s
Forskere udvikler syntetiske stilladser til at helbrede skadede sener og ledbåndForskningen håber at forbedre resultaterne af sportsskadeoperationer. Kredit:Pixabay Australiens kærlighed til sport betyder, at det har en af de højeste forekomster af forreste korsbånd (ACL) s
- Videnskabelige fremskridt kan resultere i menneskelig udryddelse
- Kinesisk kærlighedsrevolution skildret gennem studier af vestlige kulturelle påvirkninger
- Opdagelse af, hvordan Taxol virker, kan føre til bedre lægemidler mod kræft
- Sandt eller falskt. Vores sol er en hvid dværgstjerne?
- Når partikler overfører energi ved at støde på hinanden, hvad hedder det?
- Hvorfor landede Apollo 11 på månen?


