Hvad er rollen som aktiveret kompleks i en kemisk reaktion?
1. Energibarriere:
* Kemiske reaktioner kræver energi til at overvinde energibarrieren mellem reaktanter og produkter.
* Det aktiverede kompleks repræsenterer denne energibarriere, det punkt, hvor bindingerne i reaktanter bryder, og nye bindinger i produkter dannes.
2. Ustabil mellemprodukt:
* Det aktiverede kompleks er en meget kortvarig art, der kun findes for en brøkdel af et sekund.
* Det er meget ustabilt og opdeles straks i enten reaktanter eller produkter.
3. Bestemmelse af reaktionshastighed:
* Den energi, der kræves for at nå det aktiverede kompleks, bestemmer reaktionshastigheden.
* Reaktioner med højere aktiveringsenergier er langsommere, fordi færre molekyler har nok energi til at nå overgangstilstanden.
4. Katalysatorindflydelse:
* Katalysatorer fungerer ved at sænke aktiveringsenergien i en reaktion.
* De gør dette ved at tilvejebringe en alternativ reaktionsvej, der involverer et lavere energiaktiveret kompleks, der fremskynder reaktionen.
5. Visualisering:
* Forestil dig en bakke, der repræsenterer energibarrieren mellem reaktanter og produkter.
* Det aktiverede kompleks er toppen af bakken, det punkt, hvor energien er højest, før molekylerne kan "rulle ned" for at danne produkter.
Kortfattet:
Det aktiverede kompleks er et kritisk mellemprodukt i kemiske reaktioner. Det repræsenterer det højeste energipunkt langs reaktionsvejen, dikterer reaktionshastigheden og er påvirket af katalysatorer. At forstå det aktiverede kompleks er afgørende for at forstå kinetikken og mekanismerne for kemiske reaktioner.
Sidste artikelHvad er kilden til carbonatomer i ethylalkohol?
Næste artikelEr K2CR2O7 en formelenhed eller molekyler?
 Varme artikler
Varme artikler
-
 Kamæleonmaterialer:Oprindelsen af farvevariation i lavdimensionelle perovskitterBredfeltsfotoluminescensmikrofotografier (230_175 μm) viser, hvordan nogle Perovskite-flager ser lysegrønne ud over hele deres område (venstre panel), mens andre flager udviser en tydeligt rødforskudt
Kamæleonmaterialer:Oprindelsen af farvevariation i lavdimensionelle perovskitterBredfeltsfotoluminescensmikrofotografier (230_175 μm) viser, hvordan nogle Perovskite-flager ser lysegrønne ud over hele deres område (venstre panel), mens andre flager udviser en tydeligt rødforskudt -
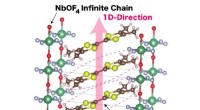 Forskere opdager ny organisk lederKrystalstruktur af en-dimensionel ladningsoverføringssalt med en uendelig anionkæde (TMTTF) (NbOF 4 ) Kredit:NINS/IMS Salte er langt mere komplicerede end fødevarekrydderiet - de kan endda funge
Forskere opdager ny organisk lederKrystalstruktur af en-dimensionel ladningsoverføringssalt med en uendelig anionkæde (TMTTF) (NbOF 4 ) Kredit:NINS/IMS Salte er langt mere komplicerede end fødevarekrydderiet - de kan endda funge -
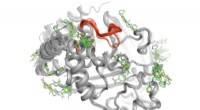 Forskere opdager en måde at kigge inde i proteiner for at se, hvordan de er forbundetEn high-throughput-metode afslører, hvor over 100 små molekyler binder til proteinet PTP1B. Nogle få af disse bindingsområder kan sende signaler til det aktive sted (rødt) for at kontrollere PTP1Bs ak
Forskere opdager en måde at kigge inde i proteiner for at se, hvordan de er forbundetEn high-throughput-metode afslører, hvor over 100 små molekyler binder til proteinet PTP1B. Nogle få af disse bindingsområder kan sende signaler til det aktive sted (rødt) for at kontrollere PTP1Bs ak -
 Illinois ingeniør fortsætter med at lave bølger i vandafsaltningAdjunkt Kyle Smith. Kredit:University of Illinois. I de sidste mange år, University of Illinois-forsker Kyle Smith har bevist sin voksende ekspertise inden for vandafsaltning, med en række forskni
Illinois ingeniør fortsætter med at lave bølger i vandafsaltningAdjunkt Kyle Smith. Kredit:University of Illinois. I de sidste mange år, University of Illinois-forsker Kyle Smith har bevist sin voksende ekspertise inden for vandafsaltning, med en række forskni
- Hvis du fordobler massen af et objekt, mens du forlader nettokraften uændret, hvad er resultatet …
- Sådan tolkes drømme med tal
- Hvilke ændringer finder sted i den synlige form af måne fra dag til dag?
- Asiatisk amerikaner:Et samlingsråb, der forenede asiater i 1960'erne, men er det stadig relevant?
- Er det rigtigt, at træer regelmæssigt kan brændes i store mængder fra en skov?
- Sensor måler yoctonewton-kræfter hurtigt


