Høj spin og lave komplekse ioner?
Høj spin og lave spin -komplekser
* spin tilstand: I overgangsmetalkomplekser kan elektroner i D -orbitaler arrangeres på to måder afhængigt af ligandfeltstyrken:
* Høj spin: Elektroner besætter orbitaler individuelt (efter Hunds regel), inden de parrer sig. Dette maksimerer antallet af uparrede elektroner, hvilket resulterer i en højere samlet spin.
* Lav spin: Elektroner parrer sig sammen i de lavere energi -orbitaler, før de besætter højere energi -orbitaler. Dette minimerer antallet af uparrede elektroner og resulterer i en lavere samlet spin.
* ligandfeltstyrke: Styrken af interaktionen mellem liganderne (molekyler eller ioner, der er fastgjort til den centrale metalion) og metalionens D -orbitaler bestemmer, om en kompleks vil være høj spin eller lav spin.
* Stærke feltligander: Disse ligander forårsager en stor opdeling af D -orbitaler, hvilket tvinger elektroner til at parre sig i lavere energi -orbitaler. Dette fører til lav spin komplekser. Eksempler inkluderer CN⁻, CO og NO₂⁻.
* svage feltligander: Disse ligander forårsager en mindre opdeling af D -orbitaler, hvilket gør det muligt for elektroner at besætte både lavere og højere energi -orbitaler individuelt. Dette resulterer i høj spin komplekser. Eksempler inkluderer i⁻, br⁻ og cl⁻.
Kompleksitet af ioner og spin tilstand
Kompleksiteten af en ion er ikke direkte bundet til, om det er høj spin eller lav spin. Her er hvad der er vigtigt at overveje:
* Koordinationsnummer: Antallet af ligander, der er direkte fastgjort til den centrale metalion. Dette påvirker kompleksets geometri og generelle struktur markant.
* ligandtyper: De typer ligander kan påvirke kompleksets stabilitet og reaktivitet.
* metalion: Selve metalion bidrager til kompleksets egenskaber. Dens elektroniske konfiguration spiller en nøglerolle i bestemmelsen af spin -tilstand.
Eksempel:
Lad os tage eksemplet med jern (II), fe²⁺:
* [Fe (H₂O) ₆] ²⁺: Dette er et højt spin-kompleks, fordi vand (H₂O) er en svag feltligand.
* [Fe (CN) ₆] ⁴⁻: Dette er et lavt spin-kompleks, fordi cyanid (CN⁻) er en stærk feltligand.
Begge komplekser har det samme koordinationsnummer (6) og metalion (Fe²⁺), men deres spin -tilstande er forskellige på grund af ligandets indflydelse.
Key Takeaway:
Mens en kompleks ion's spin -tilstand bestemmes af ligandfeltstyrken, er kompleksiteten af ion mere relateret til dets koordinationsnummer, ligandtyper og metalionidentitet.
Sidste artikelHvilke solide genstande har en densitet på 1?
Næste artikelLyder faste stoffer bedre end væsker og gasser?
 Varme artikler
Varme artikler
-
 Forskere udtænker en billigere og hurtigere måde at kontinuerligt producere aminer påForskere ved North Carolina State University har udviklet en hurtigere og billigere teknik til fremstilling af hindrede aminer - en klasse af kemikalier, der bruges som byggesten i produkter lige fra
Forskere udtænker en billigere og hurtigere måde at kontinuerligt producere aminer påForskere ved North Carolina State University har udviklet en hurtigere og billigere teknik til fremstilling af hindrede aminer - en klasse af kemikalier, der bruges som byggesten i produkter lige fra -
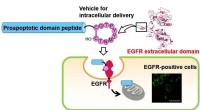 Opdagelsen af et nyt køretøjspeptid åbner en rute til levering af lægemidlerCyklisk decapeptid, som efterligner dimeriseringsarmen af EGF-receptoren (EGFR), blev tidligere fundet at være fanget i celler. Forfatterne har fundet det lovende potentiale for dette peptid som en
Opdagelsen af et nyt køretøjspeptid åbner en rute til levering af lægemidlerCyklisk decapeptid, som efterligner dimeriseringsarmen af EGF-receptoren (EGFR), blev tidligere fundet at være fanget i celler. Forfatterne har fundet det lovende potentiale for dette peptid som en -
 Ny teknik kan registrere urenheder i hakket oksekød inden for få minutterYaxi Hu indlæser et spektrometer med en prøve af hakket oksekød i fødevareforskningslaboratoriet på UBC. Kredit:Paul Joseph/UBC Forskere ved University of British Columbia har fundet en bedre måde
Ny teknik kan registrere urenheder i hakket oksekød inden for få minutterYaxi Hu indlæser et spektrometer med en prøve af hakket oksekød i fødevareforskningslaboratoriet på UBC. Kredit:Paul Joseph/UBC Forskere ved University of British Columbia har fundet en bedre måde -
 Præcisionseksperimenter afslører huller i van der Waals teoriKredit:University of Tsukuba Opdagelsen af grafen, med sit høje styrke-til-vægt-forhold, fleksibilitet, elektrisk ledningsevne, og evnen til at danne en uigennemtrængelig barriere, førte til en
Præcisionseksperimenter afslører huller i van der Waals teoriKredit:University of Tsukuba Opdagelsen af grafen, med sit høje styrke-til-vægt-forhold, fleksibilitet, elektrisk ledningsevne, og evnen til at danne en uigennemtrængelig barriere, førte til en
- G344.7-0.1:Når en stabil stjerne eksploderer
- Nye arter af sjældne gamle orme opdaget i fossilt hotspot
- Hvordan satellitdata førte til et gennembrud for Lake Erie-giftige algeopblomstringer
- At forstå, hvordan små organiske ioner stabiliserer guldnanopartikler, kan give bedre kontrol
- Hvad er to eller flere stoffer, der sammen, men ikke kombineres for at danne et nyt rent stof?
- Hvordan Spredes Frøfrø?


