Brug den kinetiske teori til at forklare kondens?
kondens forklaret af kinetisk teori
Den kinetiske teori om stof forklarer kondens smukt ved at fokusere på den konstante bevægelse af molekyler og deres interaktioner. Her er sammenbruddet:
1. Molekylær bevægelse:
* gasfase: I gasfasen er molekyler langt fra hinanden og bevæger sig hurtigt med høj kinetisk energi. De kolliderer ofte og hopper hinanden tilfældigt.
* flydende fase: I den flydende fase er molekyler tættere sammen, bevæger sig mindre frit og med lavere kinetisk energi. De kolliderer stadig, men de oplever også attraktive kræfter mellem hinanden.
2. Kondens:Et skift i energi og afstand:
* afkøling: Når en gas afkøles, mister dens molekyler kinetisk energi. De bevæger sig langsommere og kolliderer sjældnere.
* attraktive kræfter: Når molekyler bremser, bliver attraktive kræfter mellem dem mere markante. Disse kræfter trækker molekyler tættere sammen.
* Liquiddannelse: Til sidst klumper molekylerne sammen og danner en væske. De attraktive kræfter holder molekylerne tæt på, men de har stadig nok energi til at bevæge sig rundt i hinanden.
3. Dynamisk ligevægt:
* Fordampning: Selv i den flydende fase har nogle molekyler stadig nok kinetisk energi til at bryde fri fra de attraktive kræfter og undslippe i gasfasen (dette kaldes fordampning).
* kondens mod fordampning: Kondensationshastigheden og fordampningshastigheden konkurrerer konstant.
* Mætningspunkt: Når kondensens hastighed svarer til fordampningshastigheden, siges luften at være mættet. Dette er det punkt, hvor ikke mere gas kan kondensere til væske.
4. Roll af overfladespænding:
* Kondensationkerner: Kondensation forekommer ofte på overflader, som støvpartikler eller andre små partikler i luften. Disse overflader tilvejebringer en "kerne" til vandmolekyler til at kondensere omkring.
* overfladespænding: De attraktive kræfter mellem vandmolekyler skaber overfladespænding, hvilket får dråber til at dannes i en sfærisk form.
Kortfattet: Kondensation er overgangen af en gas til en væske, drevet af et fald i kinetisk energi og en stigning i påvirkningen af attraktive kræfter mellem molekyler. Det er en dynamisk proces, hvor kondens og fordampning forekommer samtidig og når en ligevægt ved mætningspunktet.
Sidste artikelHvorfor er det vanskeligt at måle gasser?
Næste artikelHvilken type stråling ioniserer ikke stoffer?
 Varme artikler
Varme artikler
-
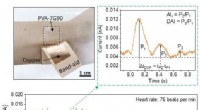 Opfindelsen tilbyder en ny mulighed for overvågning af hjertesundhedEt team fra Purdue University udviklede selvdrevne bærbare triboelektriske nanogeneratorer med polyvinylalkohol-baserede kontaktlag til overvågning af kardiovaskulær sundhed. Kredit:Wenzhuo Wu/Purdue
Opfindelsen tilbyder en ny mulighed for overvågning af hjertesundhedEt team fra Purdue University udviklede selvdrevne bærbare triboelektriske nanogeneratorer med polyvinylalkohol-baserede kontaktlag til overvågning af kardiovaskulær sundhed. Kredit:Wenzhuo Wu/Purdue -
 En katalysator for udviklingen af kulstofneutral teknologi for strålingsacceleratorenOperando blød røntgenabsorptionsspektroskopi baseret på strålingsaccelerator. Kredit:Korea Institute of Science and Technology (KIST) Betydningen af kulstofneutralitet vokser mere end nogensinde,
En katalysator for udviklingen af kulstofneutral teknologi for strålingsacceleratorenOperando blød røntgenabsorptionsspektroskopi baseret på strålingsaccelerator. Kredit:Korea Institute of Science and Technology (KIST) Betydningen af kulstofneutralitet vokser mere end nogensinde, -
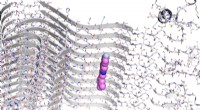 Forskere opdager nye molekyler til sporing af Parkinsons sygdomDen kemiske struktur af en alfa-synuclein fibril med et eksemplarisk molekyle, vist som farvede kugler, bundet til et tidligere identificeret bindingssted. Forskere ved Penn demonstrerede for nylig en
Forskere opdager nye molekyler til sporing af Parkinsons sygdomDen kemiske struktur af en alfa-synuclein fibril med et eksemplarisk molekyle, vist som farvede kugler, bundet til et tidligere identificeret bindingssted. Forskere ved Penn demonstrerede for nylig en -
 Fra gamle jeans til ny T-shirtviklet op på en spole, viskosefilamentgarnet blev spundet af genbrugsbomuld tilvejebragt i form af celluloseark. Forskere ved Fraunhofer IAP har fundet en måde at forvandle bomuldstøj som jeans til ny
Fra gamle jeans til ny T-shirtviklet op på en spole, viskosefilamentgarnet blev spundet af genbrugsbomuld tilvejebragt i form af celluloseark. Forskere ved Fraunhofer IAP har fundet en måde at forvandle bomuldstøj som jeans til ny
- Molekylær kirurgi omformer levende væv med elektricitet, men uden indsnit
- Er ledere født eller skabt? Ny undersøgelse viser, hvordan ledelse udvikler sig
- Waymo selvkørende rigge til at trække Google-last
- Hvor mange atomer er der i 1,3 x 1022 molekyler af NO2?
- Hvad er princippet om dominans og recessivitet?
- COVID-19 bør ikke nødvendigvis varsle en økonomisk nedtur


