Et atoms reaktivitet skyldes dets antal og arrangement i det ydre energiniveau eller bane?
* Valenselektroner: Dette er elektronerne i det yderste energiniveau. Det er dem, der er involveret i kemisk binding, hvilket er grundlaget for reaktivitet.
* octet regel: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration med otte valenselektroner (som de ædle gasser). Denne stabilitet er drivkraften bag kemiske reaktioner.
* Antal valenselektroner: Antallet af valenselektroner bestemmer, hvor let et atom vil danne bindinger. Atomer med næsten en fuld ydre skal (f.eks. Halogener) har en tendens til at vinde elektroner, mens atomer med få valenselektroner (f.eks. Alkalimetaller) har en tendens til at miste dem.
* Arrangement af valenselektroner: Det specifikke arrangement af valenselektroner påvirker de typer bindinger, et atom kan danne (enkelt, dobbelt, tredobbelt bindinger).
Eksempel:
* natrium (NA) Har en valenselektron, hvilket gør det meget reaktivt. Det mister let dette elektron for at opnå en stabil oktet.
* klor (Cl) Har syv valenselektroner. Det får let et elektron for at opnå en stabil oktet, hvilket gør det reaktivt.
* neon (NE) Har en fuld ydre skal med otte elektroner. Det er meget stabilt og ureaktivt.
Kortfattet: Antallet og arrangementet af valenselektroner bestemmer, hvor let et atom vil deltage i kemiske reaktioner, og dermed dens reaktivitet.
 Varme artikler
Varme artikler
-
 Fremstilling af læderlignende materialer fra svampeKredit:Pixabay/CC0 Public Domain Traditionelt læder og dets alternativer fås typisk fra dyr og syntetiske polymerer. Læder kan betragtes som et samprodukt af kødproduktion med både husdyrbrug og l
Fremstilling af læderlignende materialer fra svampeKredit:Pixabay/CC0 Public Domain Traditionelt læder og dets alternativer fås typisk fra dyr og syntetiske polymerer. Læder kan betragtes som et samprodukt af kødproduktion med både husdyrbrug og l -
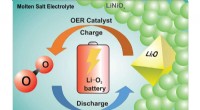 Kemikere får gennembrud på vejen til at skabe et genopladeligt lithium-oxygen-batteriEn fire-elektron redoxproces i en Li-oxygencelle elektrokatalyseres af en bifunktionel lithieret nikkeloxid-smeltet saltkompositkatode ved forhøjet temperatur til dannelse af Li2O. Det udvikler ilt ve
Kemikere får gennembrud på vejen til at skabe et genopladeligt lithium-oxygen-batteriEn fire-elektron redoxproces i en Li-oxygencelle elektrokatalyseres af en bifunktionel lithieret nikkeloxid-smeltet saltkompositkatode ved forhøjet temperatur til dannelse af Li2O. Det udvikler ilt ve -
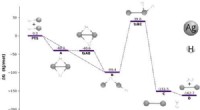 Kvantekemikere fremmaner opskrift til at blive guld, sølv og kobber i beholdere med grøn energiGratis energiprofil for reaktionen, der involverer AgH -monomerer. D svarer til Ag2- og H2 -molekylerne ved dissociationsgrænsen. Alle de frie energier (i kJ ⋅ mol − 1) blev opnået ved MP2/aug-cc-pVQZ
Kvantekemikere fremmaner opskrift til at blive guld, sølv og kobber i beholdere med grøn energiGratis energiprofil for reaktionen, der involverer AgH -monomerer. D svarer til Ag2- og H2 -molekylerne ved dissociationsgrænsen. Alle de frie energier (i kJ ⋅ mol − 1) blev opnået ved MP2/aug-cc-pVQZ -
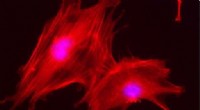 Biomaterialer til regenerering af knogle- og bruskvæv fra æbleaffaldOsteoblastceller fra en mus, der vokser på 3D-matricer og udvikles fra affald fra fødevareindustrien. Kredit:Milagros Ramos, Ángeles Martín, Malcolm Yates og Violeta Zurdo (CTB-UPM og CSIC) Forske
Biomaterialer til regenerering af knogle- og bruskvæv fra æbleaffaldOsteoblastceller fra en mus, der vokser på 3D-matricer og udvikles fra affald fra fødevareindustrien. Kredit:Milagros Ramos, Ángeles Martín, Malcolm Yates og Violeta Zurdo (CTB-UPM og CSIC) Forske
- Hvor meget natriumnitrat produceres når 1,7G sølv og 1,5G iodid reagerede?
- Er skiferlys medium eller tungt?
- Hvad findes der i områder på overfladen, der er placeret direkte over grænserne af litosfæreplad…
- Hvordan ændrer ændringer i energi transport og stopafstande?
- Når en forbindelse fungerer som en elektronacceptor, oxideres den?
- Solbrint:Lad os overveje stabiliteten af fotoelektroder


