Hvordan adskiller den moderne model af et atom fra Bohr -atommodellen?
Bohr Atomic Model (1913):
* Planetarisk model: Forestil dig et miniature solsystem. Modellen har en positivt ladet kerne i midten, hvor elektroner kredser rundt om den i faste, cirkulære stier kaldet kredsløb.
* Kvantiserede baner: Elektroner kan kun eksistere i specifikke, kvantiserede kredsløb, hvilket betyder, at de kun kan hoppe mellem disse definerede energiniveau. Når en elektron bevæger sig mellem kredsløb, absorberer eller udsender det en foton af lys med specifik energi.
* Begrænsninger:
* Kunne ikke forklare spektre for atomer med mere end en elektron.
* Kunne ikke redegøre for Zeeman -effekten (opdeling af spektrale linjer i et magnetfelt).
* Forklarede ikke den kemiske binding mellem atomer.
Modern Model of the Atom (Quantum Mechanical Model):
* Elektronsky: Modellen opgiver ideen om elektroner, der kredserer på faste stier. I stedet beskriver den elektroner som eksisterende i en sandsynlighedssky omkring kernen. Denne sky, kaldet en elektron orbital, repræsenterer de regioner, hvor elektroner mest sandsynligt findes.
* kvantetal: Elektroner er beskrevet ved hjælp af et sæt med fire kvantetal, der definerer deres energi, vinkelmoment, magnetisk øjeblik og spin. Disse tal bestemmer formen og størrelsen på elektron orbital.
* bølgepartikel dualitet: Modellen indeholder bølgepartikel-dualiteten af elektroner. Elektroner kan udvise både bølge-lignende og partikellignende opførsel.
* Usikkerhedsprincip: Heisenberg -usikkerhedsprincippet siger, at det er umuligt at samtidig bestemme både positionen og momentumet for et elektron med absolut sikkerhed.
Nøgleforskelle:
* Orbit vs. Orbital: Bohr -modellen bruger kredsløb, mens den moderne model bruger orbitaler. Orbits er definerede stier, mens orbitaler er sandsynlighedsregioner.
* fast sti vs. sandsynlighed: I BOHR -modellen har elektroner faste stier. I den moderne model er deres placering sandsynlig.
* Kvantiseret energi vs. kvantetal: Bohr -modellen bruger kvantiserede energiniveau. Den moderne model bruger kvantetal, der beskriver en bredere række egenskaber ud over bare energi.
* Lysemission vs. bølgepartikel dualitet: Bohr -modellen forklarer lysemission gennem elektronhopp. Den moderne model indeholder bølgepartikel-dualiteten af elektroner og forklarer deres opførsel mere omfattende.
Kortfattet:
Den moderne kvantemekaniske model af atomet giver en meget mere nøjagtig og sofistikeret beskrivelse af atomet end BohR -modellen. Det inkorporerer elektronernes bølgekarakter og usikkerhedsprincippet, hvilket fører til en mere komplet forståelse af atomstruktur og adfærd.
Sidste artikelHvad gør partiklerne af en solid?
Næste artikelHvad er betydningen af en nul masseaflæsning for nogle stoffer?
 Varme artikler
Varme artikler
-
 Forskere er ved at opdage måder at eliminere PFAS på, men dette voksende globale sundhedsproblem f…Kredit:Pixabay/CC0 Public Domain PFAS-kemikalier virkede som en god idé i starten. Som teflon gjorde de potter nemmere at rengøre fra 1940erne. De gjorde jakker vandtætte og gulvtæpper pletafvisend
Forskere er ved at opdage måder at eliminere PFAS på, men dette voksende globale sundhedsproblem f…Kredit:Pixabay/CC0 Public Domain PFAS-kemikalier virkede som en god idé i starten. Som teflon gjorde de potter nemmere at rengøre fra 1940erne. De gjorde jakker vandtætte og gulvtæpper pletafvisend -
 Brug af elektricitet til at nedbryde forurenende stoffer efter spildevandsrensningKredit:CC0 Public Domain Pesticider, farmaceutiske produkter, og hormonforstyrrende stoffer er nye forurenende stoffer, der ofte findes i renset husspildevand, selv efter sekundær behandling. Prof
Brug af elektricitet til at nedbryde forurenende stoffer efter spildevandsrensningKredit:CC0 Public Domain Pesticider, farmaceutiske produkter, og hormonforstyrrende stoffer er nye forurenende stoffer, der ofte findes i renset husspildevand, selv efter sekundær behandling. Prof -
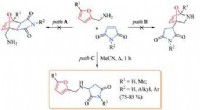 Kemikere identificerer strukturen af midlet, der forårsager mutationer i løvefiskembryonerSynteseskema af 7-oxa-2-azabicyclo[2.2.1]hept-5-en og dets struktur. Kredit:Fedor Zubkov Forskere fra Peoples Friendship University of Russia (RUDN University) har forfinet vores forståelse af str
Kemikere identificerer strukturen af midlet, der forårsager mutationer i løvefiskembryonerSynteseskema af 7-oxa-2-azabicyclo[2.2.1]hept-5-en og dets struktur. Kredit:Fedor Zubkov Forskere fra Peoples Friendship University of Russia (RUDN University) har forfinet vores forståelse af str -
 Det er et spørgsmål om gradienterKredit:P. Rona / NOAA fotobibliotek Termoforese til energiforsyning af tidlige celler. NIM -videnskabsmand Dr. Christof Mast og hans team foreslår termisk drevet dannelse af pH -gradienter og prot
Det er et spørgsmål om gradienterKredit:P. Rona / NOAA fotobibliotek Termoforese til energiforsyning af tidlige celler. NIM -videnskabsmand Dr. Christof Mast og hans team foreslår termisk drevet dannelse af pH -gradienter og prot
- Bestem ændringen i volumen, der finder sted, når 1,95-L prøve af N2g opvarmes fra 250,0 K til 442…
- Hvilken er en del af planteceller, der ikke er til stede i dyreceller?
- Hvad er energikonvertering af en tørretumbler?
- Sådan fungerer Jerusalems syndrom
- Hvad er den mindste upththust -kraft, der er nødvendig, så og objekt, der vejer 1600 N, flyder?
- Hvad er et eksempel på konvergent udvikling i tundraen?


