Hvorfor producerer forskellige atomer farver af lys?
1. Energiniveau: Elektroner i et atom kan kun eksistere ved specifikke energiniveauer, som trin på en stige. Disse niveauer er kvantiseret, hvilket betyder, at de kun kan have specifikke diskrete mængder energi.
2. excitation: Når et atom absorberer energi (f.eks. Fra varme eller lys), kan en elektron hoppe til et højere energiniveau. Denne ophidsede tilstand er ustabil.
3. de-excitation: For at vende tilbage til sin stabile jordtilstand frigiver den ophidsede elektron den absorberede energi som lys. Energien i dette lys svarer til energiforskellen mellem de højere og lavere energiniveau.
4. specifikke energiforskelle: Hvert element har et unikt arrangement af energiniveauet. Dette betyder, at energiforskellene mellem niveauer er unikke for hvert element, hvilket fører til emission af specifikke bølgelængder (farver) af lys.
5. spektre: Når lys, der udsendes fra ophidsede atomer, føres gennem et prisme, adskilles det i et unikt mønster af farvede linjer kaldet et emissionsspektrum. Dette spektrum fungerer som et fingeraftryk og identificerer det element, der er ansvarligt for lyset.
Eksempel:
* natrium: Natriumatomer har en specifik energiforskel, der svarer til det gule område af det synlige spektrum. Så når natrium opvarmes, udsender det gult lys.
* brint: Hydrogenatomer udsender specifikke farver på lys, såsom rød, blågrøn og violet, på grund af de unikke energiforskelle mellem dens elektronenerginiveau.
Konklusion:
De specifikke farver på lys, der udsendes af forskellige atomer, er et resultat af de unikke energiforskelle mellem deres elektronenerginiveau. Dette princip er grundlaget for spektroskopi, en teknik, der bruges til at identificere og analysere elementer baseret på deres spektrale "fingeraftryk."
 Varme artikler
Varme artikler
-
 Høst rent brintbrændstof gennem kunstig fotosynteseDet farvede elektronmikroskopbillede viser galliumnitridtårnene i den kunstige fotosynteseanordning ved 52,5k forstørrelse. Disse nanostrukturer river vandmolekyler fra hinanden til brint og ilt for a
Høst rent brintbrændstof gennem kunstig fotosynteseDet farvede elektronmikroskopbillede viser galliumnitridtårnene i den kunstige fotosynteseanordning ved 52,5k forstørrelse. Disse nanostrukturer river vandmolekyler fra hinanden til brint og ilt for a -
 Gammelt brød bliver til nye tekstilerKredit:Borås Universitet Er det muligt at lave tekstiler af gammelt brød? Akram Zamani, universitetslektor i ressourcegenvinding ved universitetet i Borås, vil finde ud af det. Og hun er allerede
Gammelt brød bliver til nye tekstilerKredit:Borås Universitet Er det muligt at lave tekstiler af gammelt brød? Akram Zamani, universitetslektor i ressourcegenvinding ved universitetet i Borås, vil finde ud af det. Og hun er allerede -
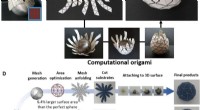 Computational origami:En universel metode til at indpakke 3-D buede overflader med ikke-strækbare m…Reverse engineering computerorigami til konform indpakning. (A) Rynker dannes ved tæt indpakning af et rektangulært ark papir omkring en ikke -nul Gauss -overflade. (B) Fraktale snitmønstre kan undgå
Computational origami:En universel metode til at indpakke 3-D buede overflader med ikke-strækbare m…Reverse engineering computerorigami til konform indpakning. (A) Rynker dannes ved tæt indpakning af et rektangulært ark papir omkring en ikke -nul Gauss -overflade. (B) Fraktale snitmønstre kan undgå -
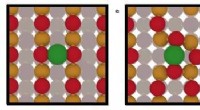 Forskere foreslår en dynamisk ladning og oxidationstilstand for enkeltatom-katalysatorerResultaterne, udgivet i Naturmaterialer , gøre det amerikanske energiministerium 150ºC udfordring for emissioner mere opnåelige. Forskere fra López-gruppen foreslår en dynamisk ladning og oxidations
Forskere foreslår en dynamisk ladning og oxidationstilstand for enkeltatom-katalysatorerResultaterne, udgivet i Naturmaterialer , gøre det amerikanske energiministerium 150ºC udfordring for emissioner mere opnåelige. Forskere fra López-gruppen foreslår en dynamisk ladning og oxidations
- Hvad er fordampningspunktet eller paraffinvoks?
- Navngiv tubluarkirtlerne, der findes mellem baser af tarmvilli?
- Spilskiftende PanDDA-metode afslører tidligere skjulte 3D-strukturdata
- Jordforsker stræber efter at hjælpe folk med at lære at gøre hvad?
- Lithium – det er ikke kun til batterier:Det pulveriserede metal kan reducere ustabilitet i fusionspl…
- Forsker undersøger nyt materiale dyrket af sukker


