Hvad sker der med atomerne i en væske, når det fryser?
1. Tab af energi: Når en væske afkøles, mister dens atomer kinetisk energi. Dette betyder, at de bevæger sig langsommere og vibrerer mindre kraftigt.
2. Nedsat afstand: Med mindre energi bliver de attraktive kræfter mellem atomer mere dominerende. Atomerne begynder at pakke tættere sammen.
3. Dannelse af en krystalgitter: I de fleste tilfælde, når væsken fortsætter med at afkøle, arrangerer atomerne sig i en meget ordnet, gentager tredimensionelt mønster kaldet en krystalgitter. Denne struktur minimerer systemets potentielle energi.
4. Nedsat bevægelsesfrihed: I et fast stof er atomerne i det væsentlige låst på plads inden for krystalgitteret. De kan stadig vibrere, men de kan ikke flytte frit fra et sted til et andet. Det er dette, der giver faste stoffer deres stivhed og fast form.
Vigtige noter:
* Ikke alle væsker fryser til krystallinske faste stoffer. Nogle stoffer, som glas, danner amorfe faste stoffer, hvor atomerne er arrangeret på en mere tilfældig, forstyrret måde.
* frysningspunkt: Den specifikke temperatur, hvormed en flydende fryser kaldes dets frysepunkt. Dette punkt afhænger af stoffet og trykket.
* faseændring: Processen med en væske, der omdannes til et fast stof, er en faseændring, og det involverer en ændring i stoftilstanden.
Kortfattet: Frysning er en proces, hvor atomer i en væske mister energi, pakker tættere sammen og danner en mere ordnet struktur, hvilket resulterer i en fast tilstand.
Sidste artikelHvor mange gram Al2O3 dannes fra 3 mol O2?
Næste artikelHvorfor er ikke -metaller dårlige ledere?
 Varme artikler
Varme artikler
-
 Døden muliggør kompleksitet i kemisk evolutionLivscyklussen for komplekse og mere simple replikatorer. De komplekse replikatorer produceres i en langsommere hastighed end de simple replikatorer, men da de er mere modstandsdygtige over for sammenb
Døden muliggør kompleksitet i kemisk evolutionLivscyklussen for komplekse og mere simple replikatorer. De komplekse replikatorer produceres i en langsommere hastighed end de simple replikatorer, men da de er mere modstandsdygtige over for sammenb -
 Celleadfærd, engang indhyllet i mystik, afsløres i nyt lysGavin King og et team af forskere ved University of Missouri er et skridt tættere på at forstå celleadfærd ved hjælp af et specialiseret mikroskop. Kredit:University of Missouri-Columbia En celles
Celleadfærd, engang indhyllet i mystik, afsløres i nyt lysGavin King og et team af forskere ved University of Missouri er et skridt tættere på at forstå celleadfærd ved hjælp af et specialiseret mikroskop. Kredit:University of Missouri-Columbia En celles -
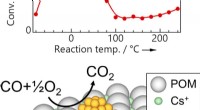 Ultraeffektiv fjernelse af kulilte ved hjælp af guld nanopartikler på en molekylær støtteNy katalysator bestående af guldnanopartikler understøttet på et Keggin-type polyoxometalat (POM) med et cæsiumsalt. Strukturen viste høj aktivitet og stabilitet for CO-oxidation; spormængder af vand
Ultraeffektiv fjernelse af kulilte ved hjælp af guld nanopartikler på en molekylær støtteNy katalysator bestående af guldnanopartikler understøttet på et Keggin-type polyoxometalat (POM) med et cæsiumsalt. Strukturen viste høj aktivitet og stabilitet for CO-oxidation; spormængder af vand -
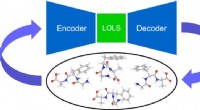 Ny maskinlæringstilgang letter molekylær konformersøgning i komplekse molekylerKredit:Aalto Universitet CEST-forskere udviklede en ny maskinlæringstilgang baseret på et lav-energi latent rum (LOLS) og densitets funktionel teori (DFT) til at søge efter molekylære konformere.
Ny maskinlæringstilgang letter molekylær konformersøgning i komplekse molekylerKredit:Aalto Universitet CEST-forskere udviklede en ny maskinlæringstilgang baseret på et lav-energi latent rum (LOLS) og densitets funktionel teori (DFT) til at søge efter molekylære konformere.
- Elektrisk potentiel energi er det opladede objekt har på grund af dets?
- Hvor mange fotoner er indeholdt i et burst af gult lys 589nm fra natriumlampe, der indeholder 609 kJ…
- Hvad er formlen for nitrogenmonoxid?
- Baggrundsundertrykkelse for lysopløselig lysmikroskopi
- Kulturel blaffer:Hvordan social adfærd kan påvirke genetisk sammensætning hos delfiner
- Hvilken energi bruges fra bioluminescens?


