Hvorfor har gasser ingen frie overflader?
Her er hvorfor:
* svage intermolekylære kræfter: Partiklerne i en gas er langt fra hinanden og har meget svage attraktive kræfter mellem dem. Dette giver dem mulighed for at bevæge sig frit og uafhængigt og konstant kollidere med hinanden og væggene i deres container.
* Tilfældig bevægelse: Gaspartikler bevæger sig i tilfældige retninger og ved høje hastigheder. Denne konstante bevægelse forhindrer dem i at forblive i en fast position, og de danner derfor ikke en tydelig overflade som væsker eller faste stoffer.
Analogi: Forestil dig et værelse fuld af hoppekugler. Kuglerne repræsenterer gaspartikler. De hopper af hinanden og væggene og ændrer konstant deres positioner. Der er ingen klar grænse eller overflade til kuglerne, bare en tilfældig fordeling i hele rummet.
Key Takeaway: Fraværet af frie overflader i gasser er en direkte konsekvens af deres unikke egenskaber:svage intermolekylære kræfter og tilfældig bevægelse.
Sidste artikelHvor mange valenselektroner besidder GA?
Næste artikelHvilken ledning i termos kolbe?
 Varme artikler
Varme artikler
-
 Selvkomprimerende beton bliver mere bæredygtig takket være at bruge granitresterEn UCO-undersøgelse beviser muligheden for at erstatte op til 40% af konventionelle tilslag af selvkomprimerende mørtel med granitslam, dermed reducere byggesektorens miljøbelastning. Kredit:Universit
Selvkomprimerende beton bliver mere bæredygtig takket være at bruge granitresterEn UCO-undersøgelse beviser muligheden for at erstatte op til 40% af konventionelle tilslag af selvkomprimerende mørtel med granitslam, dermed reducere byggesektorens miljøbelastning. Kredit:Universit -
 Mikro-/nano-arkitekturer i MOF-membran fremskynder olie-vandseparation(en, b) SEM-billeder og (c) af AFM-billede ZIF-8-belagt mesh-membran; (d) Fotografiet af flere oliedråber på ZIF-8-belagt mesh-membran. Kredit:© Science China Press Hyppige olieudslip under olietr
Mikro-/nano-arkitekturer i MOF-membran fremskynder olie-vandseparation(en, b) SEM-billeder og (c) af AFM-billede ZIF-8-belagt mesh-membran; (d) Fotografiet af flere oliedråber på ZIF-8-belagt mesh-membran. Kredit:© Science China Press Hyppige olieudslip under olietr -
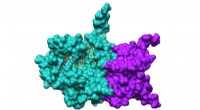 Forskere bruger Theta til analyse i realtid af COVID-19 proteinerNsp10/16 overflade med ligander. Forskere har udviklet en pipeline til at forbinde ALCF-supercomputere med APS-eksperimenter for at muliggøre analyse i realtid af COVID-19-proteiner, baner vejen for a
Forskere bruger Theta til analyse i realtid af COVID-19 proteinerNsp10/16 overflade med ligander. Forskere har udviklet en pipeline til at forbinde ALCF-supercomputere med APS-eksperimenter for at muliggøre analyse i realtid af COVID-19-proteiner, baner vejen for a -
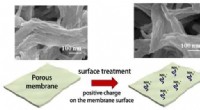 Udvikling af ultratynd holdbar membran til effektiv olie- og vandseparationFigur 1:SEM-billeder og diagram, der viser dannelsen af det ultratynde silicalag på den porøse membran. Kredit:Kobe University Forskere ledet af professor Matsuyama Hideto og professor Yoshioka
Udvikling af ultratynd holdbar membran til effektiv olie- og vandseparationFigur 1:SEM-billeder og diagram, der viser dannelsen af det ultratynde silicalag på den porøse membran. Kredit:Kobe University Forskere ledet af professor Matsuyama Hideto og professor Yoshioka
- Hvor gammel er Mælkevejen?
- Skoler ude:Hvordan klimaændringer allerede påvirker børns uddannelse hårdt
- Celler buler for at presse sig gennem barrierer
- Blandingen af to eller flere atomare orbitaler lignende energier på det samme atom for at produce…
- Undersøgelser finder, at spredning af spøgelsesskove på NC-kysten kan bidrage til klimaændringer
- Biotiske faktorer i græsset Biome


