Donerer eller accepterer metaller elektroner, og hvad bliver de?
Her er hvorfor:
* Metallisk binding: Metaller holdes sammen af et "hav" af delokaliserede elektroner. Disse elektroner er ikke tæt bundet til noget specifikt atom og kan bevæge sig frit gennem metallet.
* Elektropositivitet: Metaller har en tendens til at miste elektroner på grund af deres relativt lave elektronegativitet. Det betyder, at det er mere sandsynligt, at de giver væk elektroner end at få dem.
* Dannelse af kationer: Når et metalatom mister en eller flere elektroner, bliver det en positivt ladet ion (kation). Dette skyldes, at det nu har flere protoner (positiv ladning) end elektroner (negativ ladning).
Eksempel:
Natrium (NA) er et metal. Det har en valenselektron (elektron i dets yderste skal). Når natrium reagerer, mister det dette elektron til dannelse af en natriumion (Na +), som har en +1 ladning.
Nøglepunkt: Metaller donerer elektroner til dannelse af positive ioner, som er et grundlæggende kendetegn ved deres kemiske opførsel.
Sidste artikelHar væske en fast temperatur, men ingen form?
Næste artikelHvorfor kan gas ikke kondensere og dampkondens?
 Varme artikler
Varme artikler
-
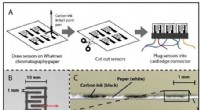 Madfriskhedssensorer kan erstatte sidste anvendelsesdatoer for at reducere madspild(A) Fremstilling af papirbaserede elektriske gassensorer (PEGS). Kulstofelektroder er trykt på WhatmanTM cellulosekromatografi 1 papir med en kuglepen og skæreplotter, tillader hurtig prototyping i de
Madfriskhedssensorer kan erstatte sidste anvendelsesdatoer for at reducere madspild(A) Fremstilling af papirbaserede elektriske gassensorer (PEGS). Kulstofelektroder er trykt på WhatmanTM cellulosekromatografi 1 papir med en kuglepen og skæreplotter, tillader hurtig prototyping i de -
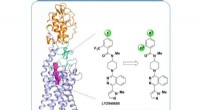 Forskere dechifrerer multi-domænet, struktur i fuld længde af den menneskelige glattede receptorStruktur af multi-domæne human Smoothened receptor, et vigtigt lægemiddelmål for kræftsygdomme. Kredit:ShanghaiTech University Et team af forskere ledet af iHuman Institute of ShanghaiTech Univers
Forskere dechifrerer multi-domænet, struktur i fuld længde af den menneskelige glattede receptorStruktur af multi-domæne human Smoothened receptor, et vigtigt lægemiddelmål for kræftsygdomme. Kredit:ShanghaiTech University Et team af forskere ledet af iHuman Institute of ShanghaiTech Univers -
 Forskellige teknikker er nødvendige for at opdage fingermærker på nye sedlerKredit:CC0 Public Domain Teknikker, der bruges til at opdage fingermærker på traditionelle bomuldssedler, er ikke effektive på skotske bankers nye polymernoter, og forskellige metoder er påkrævet,
Forskellige teknikker er nødvendige for at opdage fingermærker på nye sedlerKredit:CC0 Public Domain Teknikker, der bruges til at opdage fingermærker på traditionelle bomuldssedler, er ikke effektive på skotske bankers nye polymernoter, og forskellige metoder er påkrævet, -
 Oprettelse af materialer på en ny måde ved hjælp af 3D-trykbakterierKredit:ACS (Phys.org) – Et team af forskere ved Delft University of Technology har udviklet et middel til 3D-print af en gel indeholdende bakterier på en base for at skabe materialer på en ny måde
Oprettelse af materialer på en ny måde ved hjælp af 3D-trykbakterierKredit:ACS (Phys.org) – Et team af forskere ved Delft University of Technology har udviklet et middel til 3D-print af en gel indeholdende bakterier på en base for at skabe materialer på en ny måde
- GM reducerer resultatprognosen for 2018, siger handelskrig ramte bilsalget
- Hvordan kortlægger forskere funktioner på havbunden ved hjælp af Sonar?
- ESAs seksbenede Suntracker, der flyver på en drage
- Hvilken energiforbrug energi?
- NASA observerer dannelsen af Tropical Depression 09W i det nordvestlige Stillehav
- Hvilken type stjerne ville følge Path Stars Evolution?


