Hvordan er den moderne atomteori forskellig fra Daltons -teorien?
Daltons atomteori:
* atomer er udelelige og uforglemmelige: Dette er nu kendt for at være forkert. Atomer består af mindre subatomære partikler (protoner, neutroner og elektroner).
* Alle atomer af et givet element er identiske: Dette er også forkert. Isotoper af det samme element har forskellige antal neutroner, hvilket gør dem lidt forskellige i masse.
* atomer af forskellige elementer har forskellige masser: Dette er korrekt. Forskellige elementer har forskellige antal protoner, hvilket resulterer i forskellige atommasser.
* atomer kombineres i forhold mellem hele antal for at danne forbindelser: Dette betragtes stadig som gyldigt, hvilket afspejler ideen om kemiske formler og støkiometri.
Moderne atomteori:
* atomer kan deles og består af subatomære partikler: Opdagelsen af protoner, neutroner og elektroner og den efterfølgende udvikling af kvantemekanik ændrede vores forståelse af atomets struktur.
* atomer af det samme element kan have forskellige antal neutroner (isotoper): Isotoper har det samme antal protoner, men forskellige antal neutroner, hvilket fører til variationer i atommasse.
* Elektroner besætter specifikke energiniveauer (orbitaler): Elektroner kredser ikke kernen på en defineret sti som planeter omkring solen. I stedet besætter de specifikke energiniveauer, der svarer til forskellige orbitaler.
* atomer kan få, miste eller dele elektroner til dannelse af bindinger: Dette forklarer kemiske reaktioner, hvor atomer interagerer ved at overføre eller dele elektroner til dannelse af molekyler.
Kortfattet:
Moderne atomteori har forfinet og udvidet efter Daltons teori og inkorporeret opdagelsen af subatomære partikler, eksistensen af isotoper og elektronernes kvante karakter. Mens Daltons teori lagde grundlaget for vores forståelse af stof, giver moderne atomteori et meget mere detaljeret og nøjagtigt billede af atomets struktur og opførsel.
Sidste artikelEr arsen en leder af varme og elektricitet?
Næste artikelForklar, hvorfor væsker er mere vanskelige at komprimere end gasser?
 Varme artikler
Varme artikler
-
 Åndeprøver kan snuse til COVID-19Et transmissionselektronmikrograf af SARS-CoV-2-viruspartikler (UK B.1.1.7-variant), isoleret fra en patientprøve og dyrket i cellekultur. Kredit:NIAID Siden maj 2021 har chauffører, der krydser S
Åndeprøver kan snuse til COVID-19Et transmissionselektronmikrograf af SARS-CoV-2-viruspartikler (UK B.1.1.7-variant), isoleret fra en patientprøve og dyrket i cellekultur. Kredit:NIAID Siden maj 2021 har chauffører, der krydser S -
 Muskellignende materiale udvider sig og trækker sig sammen som reaktion på lysEn polymer (venstre; beige materiale) trækker sig sammen i blåt lys (højre). Kredit:Jonathan Barnes Ligesom medicin med kontrolleret frigivelse langsomt uddeler deres last, efter at de oplever en
Muskellignende materiale udvider sig og trækker sig sammen som reaktion på lysEn polymer (venstre; beige materiale) trækker sig sammen i blåt lys (højre). Kredit:Jonathan Barnes Ligesom medicin med kontrolleret frigivelse langsomt uddeler deres last, efter at de oplever en -
 Et meget følsomt SERS-substrat til gassensingSERS-sensoren. Kredit:SIBET Sporgassensing er afgørende for overvågning af miljøforurening og detektering af flygtige organiske forbindelser frigivet fra den menneskelige krop. Som et kraftfuldt a
Et meget følsomt SERS-substrat til gassensingSERS-sensoren. Kredit:SIBET Sporgassensing er afgørende for overvågning af miljøforurening og detektering af flygtige organiske forbindelser frigivet fra den menneskelige krop. Som et kraftfuldt a -
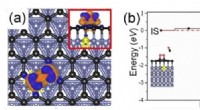 Højtydende grafenbaserede katalysatorerFigur viser (a) ladningsoverførsel mellem det understøttede grafen og det adsorberede O2 -molekyle, når substratet er dopet med en urenhed (i dette eksempel, et metalelement, farvekodet i gult). Blå (
Højtydende grafenbaserede katalysatorerFigur viser (a) ladningsoverførsel mellem det understøttede grafen og det adsorberede O2 -molekyle, når substratet er dopet med en urenhed (i dette eksempel, et metalelement, farvekodet i gult). Blå (
- Hvilken sætning af materie er det mindst almindelige på jorden?
- Prototype elektrisk fly tager første flyvning
- Hvorfor en snemand har mere termisk energi og matcher derefter?
- Glaciermus bevæger sig, og det har forskere stubbet
- Hvorfor forekommer acylering ved phenol snarere end carboxylsyre i salicylsyre?
- Hvad er 557 newton omregnet i pund?


