Hvad er de 3 typer kemiske bindinger?
1. ioniske bindinger: Dannet af den elektrostatiske tiltrækning mellem modsat ladede ioner. Dette forekommer, når et atom overfører en eller flere elektroner fuldstændigt til et andet atom, hvilket resulterer i en positivt ladet kation og en negativt ladet anion.
* Eksempel:Natriumchlorid (NaCl) - natrium (NA) mister et elektron for at blive en positivt ladet ion (Na+), mens chlor (CL) får et elektron til at blive en negativt ladet ion (Cl-).
2. kovalente obligationer: Dannet ved deling af elektroner mellem to atomer. Disse bindinger kan være polære eller ikke -polære afhængigt af elektronegativitetsforskellen mellem de bundne atomer.
* Eksempel:Vand (H2O) - To hydrogenatomer deler elektroner med et iltatom.
3. Metalliske obligationer: Forekommer mellem metalatomer, hvor elektroner delokaliseres og kan bevæge sig frit gennem metalgitteret. Dette skaber en stærk attraktion mellem de positivt ladede metalioner og elektronhavet.
* Eksempel:Kobber (Cu) - Kobberatomer deler deres valenselektroner og skaber et hav af elektroner, der giver mulighed for høj elektrisk ledningsevne.
Ud over disse tre hovedtyper er der andre typer obligationer, såsom:
* Hydrogenbindinger: Svage attraktioner mellem et hydrogenatom kovalent knyttet til et stærkt elektronegativt atom (som ilt eller nitrogen) og et andet elektronegativt atom. De er vigtige for mange biologiske processer.
* van der Waals Forces: Svage attraktioner mellem molekyler på grund af midlertidige udsving i elektronfordeling.
 Varme artikler
Varme artikler
-
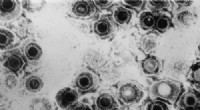 Kryo-elektronmikroskopi afslører almindelig herpesvirusstrukturHerpes simplex virus. Kredit:CDC For første gang, forskere har været i stand til at bruge kryo-elektronmikroskopi, at afsløre den detaljerede struktur af den almindelige herpesvirus. Forskere ved
Kryo-elektronmikroskopi afslører almindelig herpesvirusstrukturHerpes simplex virus. Kredit:CDC For første gang, forskere har været i stand til at bruge kryo-elektronmikroskopi, at afsløre den detaljerede struktur af den almindelige herpesvirus. Forskere ved -
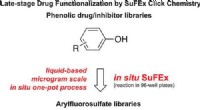 Klikkemi-reaktioner kan øge kræftbekæmpende lægemiddelstyrkeKredit:ACS Forskere ved The Scripps Research Institute (TSRI) har udviklet en hurtig og nem måde til samtidig at modificere snesevis af lægemidler eller molekyler for at forbedre deres sygdomsbekæ
Klikkemi-reaktioner kan øge kræftbekæmpende lægemiddelstyrkeKredit:ACS Forskere ved The Scripps Research Institute (TSRI) har udviklet en hurtig og nem måde til samtidig at modificere snesevis af lægemidler eller molekyler for at forbedre deres sygdomsbekæ -
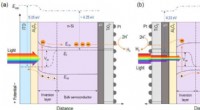 Rumlig afkobling af lysabsorption og reaktionssteder i n-Si fotokatoder til solvandssplitningSkematisk energibåndsdiagram over (a) belysningsreaktion afkoblet n-Si MIS fotokatode og (b) traditionel p-Si MIS fotokatode for HER under belysning. Kredit:Science China Press Solar-drevet fotoel
Rumlig afkobling af lysabsorption og reaktionssteder i n-Si fotokatoder til solvandssplitningSkematisk energibåndsdiagram over (a) belysningsreaktion afkoblet n-Si MIS fotokatode og (b) traditionel p-Si MIS fotokatode for HER under belysning. Kredit:Science China Press Solar-drevet fotoel -
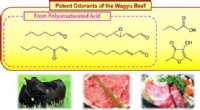 Nøgle lugtstoffer i verdens dyreste oksekød kunne hjælpe med at forklare dens tiltrækningKredit:American Chemical Society Kendt for sin bløde tekstur og karakteristiske smag, Wagyu-oksekød - ofte omtalt som Kobe-oksekød i USA - er blevet et af verdens mest eftertragtede kød. Nu i en u
Nøgle lugtstoffer i verdens dyreste oksekød kunne hjælpe med at forklare dens tiltrækningKredit:American Chemical Society Kendt for sin bløde tekstur og karakteristiske smag, Wagyu-oksekød - ofte omtalt som Kobe-oksekød i USA - er blevet et af verdens mest eftertragtede kød. Nu i en u
- Hvor mange måner kan fylde solen?
- Elektroner sammenflettet ved hjælp af nyt kvanteværktøj
- Vil skubbe på en bil altid ændre bilerne mekanisk energi Hvad skal der ske for kinetisk at stige?
- Bruger maskiner strøm til at udføre arbejde på en mere energieffektiv måde?
- Video:Vi spurgte en NASA-forsker – lignede Mars nogensinde Jorden?
- Hvad er det latinske ord hentet fra videnskaben?


