Hvordan foreslog Bohr, at partiklerne inden for er arrangeret?
* kerne: Han foreslog, at atomet har en lille, positivt ladet kerne i midten, indeholdende protoner og neutroner.
* elektroner i kredsløb: Elektroner kredser om kernen i specifikke, kvantiserede energiniveauer, som planeter, der kredser om solen. Disse kredsløb kaldes elektronskaller .
* Energiniveau: Hver elektronskal har et specifikt energiniveau. Elektroner kan hoppe mellem skaller ved at absorbere eller udsende energi (lys).
* Kvantisering: Energiniveauet for elektronskaller er kvantiseret, hvilket betyder, at elektroner kun kan eksistere ved specifikke energiniveauer. De kan ikke eksistere mellem disse niveauer.
* kvante spring: Når en elektron hopper fra et højere energiniveau til et lavere, udsender det lys med en specifik frekvens (farve). Omvendt, når et elektron absorberer lys af den korrekte frekvens, kan det hoppe til et højere energiniveau.
Vigtig note: Mens BoHR -modellen var en betydelig forbedring i forhold til tidligere modeller, har den begrænsninger. Det kan ikke forklare spektre for mere komplekse atomer, og det tegner sig ikke for elektronernes bølge-lignende natur. Mere avancerede modeller som den kvantemekaniske model har erstattet BoHR -modellen, men det er stadig et værdifuldt værktøj til at forstå det grundlæggende i atomstruktur.
Sidste artikelHvilket materiale tillader elektron at flyde?
Næste artikelHvad er en elektron degenereret gas i en hvid dværg?
 Varme artikler
Varme artikler
-
 Retsmedicinere låser op for unikke kemiske signaturer i dækTeamet fra University of Central Florida brugte laserinduceret nedbrydningsspektroskopi (LIBS) på hver prøve. Teknikken fokuserer en laser på dækprøven, som skaber et mikroskopisk plasma, der udsender
Retsmedicinere låser op for unikke kemiske signaturer i dækTeamet fra University of Central Florida brugte laserinduceret nedbrydningsspektroskopi (LIBS) på hver prøve. Teknikken fokuserer en laser på dækprøven, som skaber et mikroskopisk plasma, der udsender -
 Højtryksforskere opdager lovende materiale til informationsteknologiKredit:CC0 Public Domain Forskere ved University of Bayreuth har opdaget et usædvanligt materiale:Når det køles ned til to grader celsius, dets krystalstruktur og elektroniske egenskaber ændrer si
Højtryksforskere opdager lovende materiale til informationsteknologiKredit:CC0 Public Domain Forskere ved University of Bayreuth har opdaget et usædvanligt materiale:Når det køles ned til to grader celsius, dets krystalstruktur og elektroniske egenskaber ændrer si -
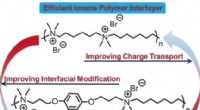 Fullerener bygger bro over ledende kløft i organisk fotovoltaikKredit:Wiley Organisk solceller har opnået bemærkelsesværdigt høje effektiviteter, men at finde optimale kombinationer af materialer til højtydende organiske solceller, som også er økonomisk konku
Fullerener bygger bro over ledende kløft i organisk fotovoltaikKredit:Wiley Organisk solceller har opnået bemærkelsesværdigt høje effektiviteter, men at finde optimale kombinationer af materialer til højtydende organiske solceller, som også er økonomisk konku -
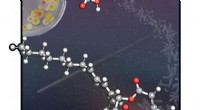 En molekylær trojansk hestDe wienske videnskabsmænd ledet af Maulide udviklede en metode, der anvender en 4-leddet ringprecursor til hurtigt at samle makrocyklussen af de naturlige produkter. Kredit:Giovanni Di Mauro/Maulide
En molekylær trojansk hestDe wienske videnskabsmænd ledet af Maulide udviklede en metode, der anvender en 4-leddet ringprecursor til hurtigt at samle makrocyklussen af de naturlige produkter. Kredit:Giovanni Di Mauro/Maulide
- Trump-administrationen kaster koldt vand på klimaforandringstruslen mod koralrevene
- Beskriv mindst tre processer, der mekanisk vejrberg?
- Kemikere tilføjer farve til kemiske reaktioner
- Halvfems år med data viser global opvarmningseffekter på grundlaget for marine økosystemer
- Gamle kyllinger set som hellige, ikke mad, viser undersøgelse
- Vi ved nu, hvordan insekter og bakterier kontrollerer is


