Opbevarer gasser det samme volumen?
* Gasser er komprimerbare: I modsætning til faste stoffer og væsker har gasser meget svage intermolekylære kræfter. Dette betyder, at deres molekyler er langt fra hinanden og kan presses tættere sammen.
* volumen afhænger af tryk og temperatur: Mængden af en gas er direkte relateret til det tryk og temperatur, den udsættes for.
* tryk: Forøgelse af trykket på en gas tvinger molekylerne tættere sammen, hvilket reducerer volumenet.
* Temperatur: Forøgelse af temperaturen på en gas giver molekylerne mere kinetisk energi, hvilket får dem til at bevæge sig hurtigere og sprede sig, hvilket øger volumenet.
Eksempel: Tænk på en ballon. Når du blæser luft ind i det, øger du presset indeni. Gasmolekylerne klemmes nærmere, hvilket øger trykket, indtil ballonen udvides.
Key Takeaway: Mængden af en gas er ikke fast og kan ændres afhængigt af de forhold, den er i.
Sidste artikelHvor mange gram NH3 har de samme antal molekyler ved 15,0 g C6H6?
Næste artikelHvilket materiale tillader elektron at flyde?
 Varme artikler
Varme artikler
-
 Overraskende opdagelse kan ændre den måde, industrien bruger nikkel påSEM-billede af korroderet nikkel på overfladen. Kredit:Mengying Liu Nikkel er et af de mest udbredte grundstoffer på jorden. Det er svært, dog formbar, magnetisk ved stuetemperatur, og en relativt
Overraskende opdagelse kan ændre den måde, industrien bruger nikkel påSEM-billede af korroderet nikkel på overfladen. Kredit:Mengying Liu Nikkel er et af de mest udbredte grundstoffer på jorden. Det er svært, dog formbar, magnetisk ved stuetemperatur, og en relativt -
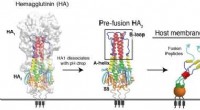 Forskere finder en ny måde at målrette mod influenzavirusRice University og Baylor College of Medicine forskere brugte computersimuleringer til at studere den proces, hvorved hæmagglutinin hjælper vira med at invadere og inficere celler. Forskerne mener, at
Forskere finder en ny måde at målrette mod influenzavirusRice University og Baylor College of Medicine forskere brugte computersimuleringer til at studere den proces, hvorved hæmagglutinin hjælper vira med at invadere og inficere celler. Forskerne mener, at -
 En ny måde at se, om der er genbrugsmateriale i den plastikflaske eller -poseTilføjelse af et fluorescerende mærke til genbrugsplast kan hjælpe med at spore deres mængde i nye engangsprodukter. Kredit:Tilpasset fra ACS Sustainable Chemistry &Engineering 2022 For at tilskynd
En ny måde at se, om der er genbrugsmateriale i den plastikflaske eller -poseTilføjelse af et fluorescerende mærke til genbrugsplast kan hjælpe med at spore deres mængde i nye engangsprodukter. Kredit:Tilpasset fra ACS Sustainable Chemistry &Engineering 2022 For at tilskynd -
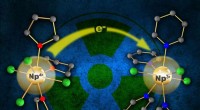 Åbner adgang til at udforske neptuniums syntetiske kemiEn ny, let fremstillet udgangsmateriale (til venstre) indeholdende neptunium (Np3+) kan let fremstilles ved en elektron (e-) overførsel til en moder neptunium (Np4+) forbindelse (højre). Denne proces
Åbner adgang til at udforske neptuniums syntetiske kemiEn ny, let fremstillet udgangsmateriale (til venstre) indeholdende neptunium (Np3+) kan let fremstilles ved en elektron (e-) overførsel til en moder neptunium (Np4+) forbindelse (højre). Denne proces
- Indonesien standser udviklingen af ny palmeolieplantage
- Hvad er forbindelserne mellem metamorfe og stødende sedimentære klipper?
- 450 meter og 10 kg hammer beregne potentiel energi?
- Hvordan er hastighed og hastighed anderledes?
- Hvorfor ser vi forskelle i udseendet og bevægelserne fra Sun Moon fra Jorden?
- Hvad er funktionen af sphenoidbenet?


