Hvordan træner du mængden af gas?
1. Brug af den ideelle gaslov:
* den ideelle gaslov: Dette er den mest almindelige og alsidige metode. Det siger:PV =NRT
* p: Presset af gassen (i Pascals, PA)
* v: Volumen af gassen (i kubikmeter, m³)
* n: Antal mol gas (i mol, mol)
* r: Ideel Gas Constant (8.314 J/Mol · K)
* t: Gasstemperaturen (i Kelvin, K)
* For at finde lydstyrken skal du omarrangere ligningen: V =(nrt) / p
Eksempel:
* Du har 2 mol af en ideel gas ved et tryk på 1 atm (101.325 PA) og en temperatur på 25 ° C (298 K).
* Konverter temperaturen til Kelvin:25 ° C + 273,15 =298,15 K
* Sæt værdierne i ligningen:V =(2 mol * 8.314 J / mol · K * 298.15 K) / 101.325 Pa
* Beregn volumen:V ≈ 0,049 m³ eller 49 liter
2. Brug af den kombinerede gaslov:
* den kombinerede gaslov: Denne lov kombinerer Boyle's Law, Charles 'lov og Gay-Lussacs lov og er nyttig til at sammenligne de indledende og endelige tilstande i en gas. Det siger:(p₁v₁) / t₁ =(p₂v₂) / t₂
* p₁: Oprindeligt tryk
* V₁: Oprindeligt bind
* t₁: Den oprindelige temperatur
* p₂: Endelig pres
* V₂: Endelig bind
* t₂: Endelig temperatur
* For at finde det endelige bind (V₂) skal du omarrangere ligningen: V₂ =(p₁v₁t₂) / (p₂t₁)
Eksempel:
* Du har 1 liter gas ved et tryk på 1 atm og en temperatur på 20 ° C (293,15 K). Trykket øges til 2 atm, og temperaturen øges til 30 ° C (303,15 K).
* Sæt værdierne i ligningen:V₂ =(1 ATM * 1 L * 303.15 K) / (2 ATM * 293.15 K)
* Beregn det endelige bind:V₂ ≈ 0,52 L
3. Brug af Avogadros lov:
* Avogadros lov: Denne lov siger, at på samme temperatur og tryk indeholder lige mængder af forskellige ideelle gasser det samme antal molekyler.
* Denne lov er nyttig til sammenligning af mængderne af to gasser med det samme antal mol.
4. Brug af den ideelle gaslov med densitet:
* den ideelle gaslov kan kombineres med definitionen af densitet (ρ =m/v) for at beregne volumen af en gas.
* Omarrangering af den ideelle gaslov og erstatter densitet, får du:V =(MRT) / (ρp)
* m: Massen af gassen (i kg)
Eksempel:
* Du har 1 kg nitrogengas (N₂) ved et tryk på 1 atm og en temperatur på 25 ° C (298 K). Tætheden af nitrogengas ved disse betingelser er ca. 1,25 kg/m³.
* Beregn volumen:V =(1 kg * 8.314 J/mol · K * 298 K)/(1,25 kg/m³ * 101,325 PA)
* Volumenet er cirka:V ≈ 0,196 m³ eller 196 liter
Vigtige overvejelser:
* Ideelle antagelser om gasret: Den ideelle gaslov antager, at gasmolekyler ikke har nogen volumen og ikke interagerer med hinanden. Dette er en god tilnærmelse for de fleste gasser ved lavt tryk og høje temperaturer.
* Ægte gasser: Ved høje tryk eller lave temperaturer afviger reelle gasser fra ideel opførsel. Det kan være nødvendigt at bruge mere komplekse ligninger til at redegøre for intermolekylære kræfter og det endelige volumen af gasmolekyler.
Husk at altid bruge konsistente enheder i dine beregninger og være opmærksomme på begrænsningerne i de metoder, du bruger.
Sidste artikelSubatomisk partikel med et afgift på plus 1?
Næste artikelHvad er den industrielle anvendelse af brydning?
 Varme artikler
Varme artikler
-
 Elektrokemi åbner ny adgang til vigtige klasser af stofferEn ung forsker i professor Waldvogels team, der bruger et screeningsapparat til parallel elektrolyseoptimering. Kredit:Alexander Sell Elektrokemi har gennemgået en renæssance i de seneste år, og m
Elektrokemi åbner ny adgang til vigtige klasser af stofferEn ung forsker i professor Waldvogels team, der bruger et screeningsapparat til parallel elektrolyseoptimering. Kredit:Alexander Sell Elektrokemi har gennemgået en renæssance i de seneste år, og m -
 Dit hår ved, hvad du spiser, og hvor meget din klipning kosterKredit:Unsplash/CC0 Public Domain Millimeter for millimeter, dit hår opbygger en registrering af din kost. Da hårstrå er bygget af aminosyrer, der kommer fra din mad, de bevarer de kemiske spor af
Dit hår ved, hvad du spiser, og hvor meget din klipning kosterKredit:Unsplash/CC0 Public Domain Millimeter for millimeter, dit hår opbygger en registrering af din kost. Da hårstrå er bygget af aminosyrer, der kommer fra din mad, de bevarer de kemiske spor af -
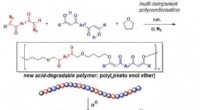 Ny syntetisk polymer nedbrydeligt under meget milde sure betingelserFremstilling af ny nedbrydelig syntetisk polymer. Kredit:Ehime University Et forskerhold ved Ehime University forberedte en ny type syntetisk polymer, som kan nedbrydes til en kombination af velde
Ny syntetisk polymer nedbrydeligt under meget milde sure betingelserFremstilling af ny nedbrydelig syntetisk polymer. Kredit:Ehime University Et forskerhold ved Ehime University forberedte en ny type syntetisk polymer, som kan nedbrydes til en kombination af velde -
 Nøglemekanismer for luftvejsafslapning ved astma afsløret i ny undersøgelseKredit:Pixabay/CC0 Public Domain Mange lægemidler til astma og andre obstruktive lungesygdomme er rettet mod β2 -adrenerg receptor (β2 AR), en G-proteinkoblet receptor (GPCR), der hurtigt understøt
Nøglemekanismer for luftvejsafslapning ved astma afsløret i ny undersøgelseKredit:Pixabay/CC0 Public Domain Mange lægemidler til astma og andre obstruktive lungesygdomme er rettet mod β2 -adrenerg receptor (β2 AR), en G-proteinkoblet receptor (GPCR), der hurtigt understøt
- Er jodkrystall en ionisk eller molekylær krystal?
- Hvad er stammeenergi på grund af torsion?
- Studerende udvikler spilteknologi til miljøvidenskabelig forskning
- Hvilke kræfter, der kredserer satellitter?
- Hvordan hjælper kuldioxid nitrogen vanddamp argon og ilt os med at leve?
- Top 10 øjeblikke i rummet Badeværelseshistorik


